آموزش جلسه 3 فصل 1 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
در مطلب قبلی با جرم اتمی عنصرها و شمارش ذرهها از روی جرم آنها آشنا شدیم. قرار است در این قسمت با کلید «نور» به مصاف شناخت جهان برویم.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل اول شیمی دهم جلسه 3
در این قسمت، بخشی از «آموزش جلسه سوم فصل اول شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
در ابتدا با هم بررسی میکنیم که طیف سنج و گستره مرئی چیست. پس از آن با مفهوم نشر نور و طیف نشری آشنا میشویم. در ادامه، علاوه بر بررسی ساختار اتم، درباره نحوه توزیع الکترونها در لایهها و زیر لایهها مطلع میشویم.
نور، کلید شناخت جهان؛ جلسه 3 فصل 1 شیمی دهم
تا حالا فکر کردید که چطور میتوانیم اجزای سازنده خورشید و ستارهها را کشف کنیم؟ به نظرتان راهی برای تشخیص دمای خورشید وجود دارد؟
به دلیل فاصله زیاد خورشید و دیگر اجسام آسمانی، بهصورت مستقیم نمیشود ویژگیهای آنها را اندازهگیری کرد. دماسنجهای معمولی هم در دماهای بسیار بالا ذوب و بدون کارایی میشوند. راه حل اندازهگیری دمای اجسام بسیار داغ و اجزای سازنده آنها چیست؟
طیف سنج
با استفاده از نور، میتوان جواب پرسشهای ایجادشده را پیدا کرد. از ستاره و سیارههای موجود در کهکشان، نوری ساطع میشود که اغلب به زمین میرسد. این نور نشان میدهد که آن ستاره یا سیاره از چه ساخته شده و دمای آن چقدر است.
با استفاده از دستگاه طیف سنج و بررسی پرتوهای گسیل شده از مواد گوناگون، میتوان اطلاعات زیادی درباره آنها کسب کرد. اینکه نور چیست؟ چگونه تولید میشود؟ حامل چه اطلاعاتی است؟
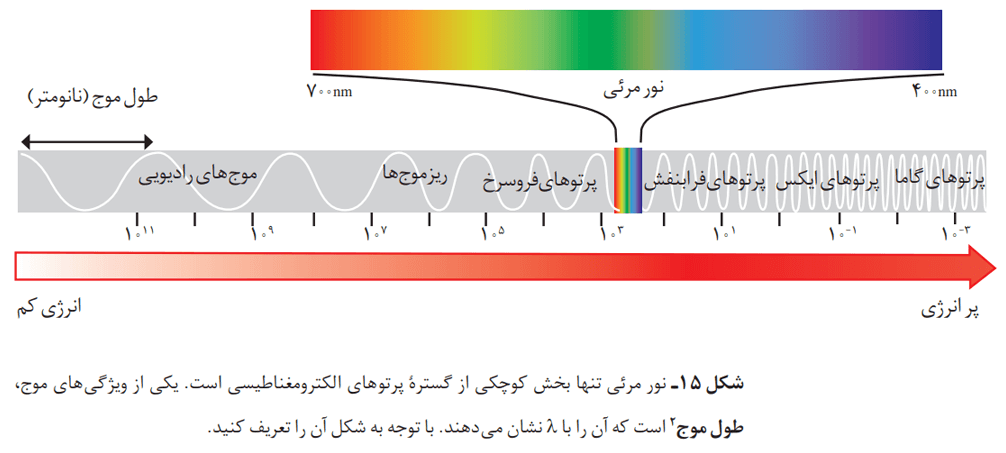
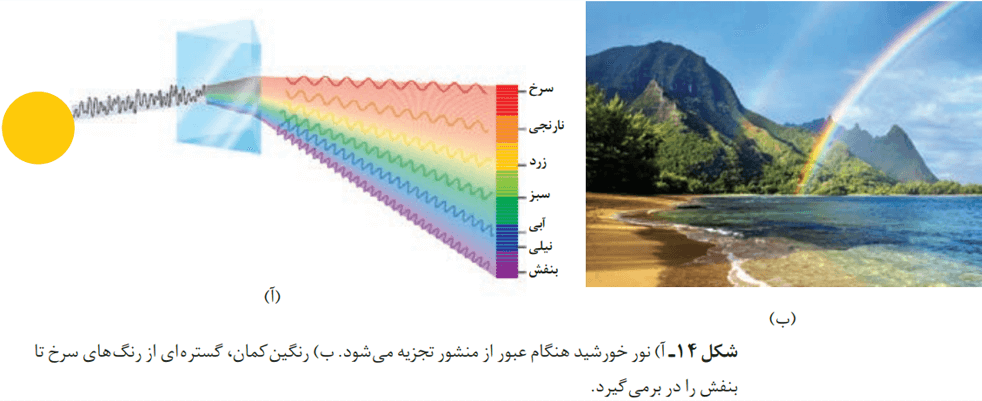
نور خورشید در حالت طبیعی، سفید به نظر میرسد. یک روز بارانی را تصور کنید که تازه بارندگی تمام شده است. در این صورت هنوز تعدادی از قطرههای آب در هوا موجودند. نور خورشید با عبور از این قطرهها تجزیه میشود و گسترهای پیوسته از رنگها ایجاد میشود. این گستره رنگی، شامل بینهایت طول موج از رنگهای گوناگون است.
گستره مرئی
چشم ما تنها میتواند گستره محدودی از نور را ببیند. به این گستره که رنگهای سرخ، نارنجی، زرد، سبز، آبی، نیلی و بنفش را در بر میگیرد، گستره مرئی میگویند.
بررسیها نشان میدهد که نور خورشید، شامل گستره بسیار بزرگتری از این پرتوهاست. این پرتوها از نوع الکترومغناطیسی هستند و با خود، انرژی حمل میکنند. هرچه طول موج این پرتوها کوتاهتر باشد، انرژی بیشتری را با خود حمل خواهند کرد. مثلا انرژی نور آبی از نور سرخ بیشتر است؛ زیرا طول موج کوتاهتری دارد.
خود را بیازمایید صفحه 21
فهمیدیم که پرتوهای گوناگون، طول موجهای متفاوتی دارند. با توجه به این ویژگی، هر یک از دماهای داده شده به کدام شکل مربوط است؟ چرا؟
هرچه طول موج نور کمتر میشود، انرژی آن بیشتر میشود. انرژی نور آبی بیشتر از زرد و زرد، بیشتر از قرمز است.
کاوش کنید صفحه 21
درباره اینکه «آیا دیگر پرتوهای الکترومغناطیس را میتوان مشاهده کرد؟» مراحل زیر را انجام دهید:
1- یک کنترل تلویزیون را که باتری آن سالم است، بردارید. از یکی از دوستان خود بخواهید که کلید روشن و خاموش آن را فشار دهد. شما هم به چشمی کنترل نگاه کنید. چه مشاهده میکنید؟
نوری مشاهده نمیکنیم.
2- قسمت 1 را تکرار کنید؛ اما این بار با دوربین یک موبایل به چشمی کنترل نگاه کنید. چه مشاهده میکنید؟ آن را توصیف کنید.
نور سفیدی از لامپ خارج میشود.
3- آزمایش را با فشردن دیگر دکمهها تکرار و مشاهدههای خود را یادداشت نمایید. چه تفاوتی مشاهده میکنید؟ توضیح دهید.
هربار، نورهای با رنگهای متفاوت دیده میشود.
4- از این مشاهدهها چه نتیجهای میگیرید؟
با فشردن دکمهها، انرژی منتقل میشود. هر رنگ طول موج و انرژی مخصوص به خود را دارد که تاثیر متفاوتی بر گیرنده میگذارد.
نشر نور و طیف نشری
آتشبازی با مواد شیمیایی، نورهای رنگی زیبا، چشمنواز و شادی بخشی را در آسمان ایجاد میکند. در جشنهای ملی و رویدادهای جهانی مانند بازیهای المپیک، اغلب بساط آتشبازی به راه است.
هر یک از این جرقههای زیبا، ناشی از وجود یک ماده شیمیایی معین در مواد آتشزاست.
رنگ شعله ترکیبهای شیمیایی
کدام جزء از یک ترکیب شیمیایی هنگام آتشبازی، رنگ را به وجود میآورد؟ طبق مشاهدات، بسیاری از نمکها شعله رنگی دارند.
اگر مقداری از محلول نمک را با افشانه روی شعله بپاشیم، رنگ شعله تغییر میکند. رنگ شعله فلز سدیم و ترکیبهای گوناگون آن مشابه و زرد رنگ است. این در حالی است که رنگ شعله فلز مس و ترکیبهای گوناگون آن مشابه و سبز رنگ است.
شعله ترکیبهای سدیم، لیتیم و مس هر یک رنگ منحصر به فردی دارد. رنگ نشر شده از هر یک، فقط باریکه بسیار کوتاهی از گستره طیف مرئی را در بر میگیرد.
طیف نشری خطی لیتیم
رنگ شعله فلز لیتیم و همه ترکیبهای آن، به رنگ سرخ است. با این حساب میشود گفت که رنگ سرخ ایجاد شده در یک شعله، میتواند نشاندهنده وجود عنصر لیتیم در آن باشد. در واقع از روی تغییر رنگ شعله میتوان به وجود عنصر فلزی در آن پی برد.
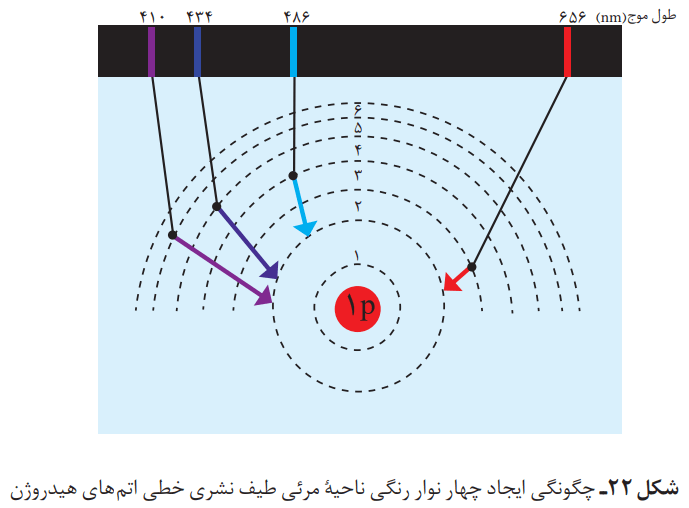
به فرایندی که در آن یک ماده شیمیایی با جذب انرژی، از خود پرتوهای الکترومغناطیس گسیل میدارد، نشر میگویند. میتوانیم نور نشر شده از یک ترکیب لیتیمدار در شعله را از یک منشور عبور دهیم. در این صورت الگویی مانند شکل زیر به دست میآید که به آن، طیف نشری خطی لیتیم میگویند.
طیف نشری خطی لیتیم در گستره مرئی، تنها شامل چهار خط یا طول موج رنگی است. از این رو به آن، طیف خطی هم میگویند.
طبق بررسیها هر عنصر، طیف نشری خطی ویژه خود را دارد. مانند اثر انگشت، برای شناسایی هر عنصر میشود از طیف آن استفاده کرد.
خط نماد (بارکد)
کاربرد طیفهای نشری خطی از برخی جهات، مانند کاربرد خط نماد (بارکد) روی جعبه یا بسته مواد غذایی و بسیاری کالاهاست. هر نوع کالا، خط نماد ویژه خود را دارد. با خواندن آن به وسیله دستگاه لیزری ویژهای که به رایانه متصل است، نوع و قیمت کالا به سرعت روی صفحه نمایشگر ظاهر میشود.
خود را بیازمایید صفحه 23
طیف نشری خطی زیر از یک عنصر تهیه شده است.
با بررسی طیفهای نشان داده شده در شکل زیر، مشخص کنید که طیف نشری بالا به کدام عنصر تعلق دارد؟ چرا؟
اتم هیدروژن، زیرا الگوی طیف نشر خطی آن، منطبق بر طیف نشر خطی هیدروژن است.
ساختار اتم
اتم هیدروژن به عنوان سادهترین اتم، تنها دارای یک پروتون در هسته و یک الکترون پیرامون آن است. در گستره مرئی طیف نشر خطی اتمهای آن، چهار خط یا نوار رنگی با طول موج و انرژی معین وجود دارد. هر نوار رنگی در طیف نشری خطی، حاوی نوری با طول موج و انرژی معین است. نیلز بور عقیده داشت که از بررسی تعداد و جایگاه آنها، میشود اطلاعات ارزشمندی از ساختار اتم هیدروژن به دست آورد.
او پس از پژوهشهای بسیار، توانست مدلی برای اتم هیدروژن ارائه کند. مدل بور با موفقیت توانست طیف نشری خطی هیدروژن را توجیه کند. با این حال، توانایی توجیه طیف نشری خطی دیگر عنصرها را نداشت.
ساختار لایهای اتم
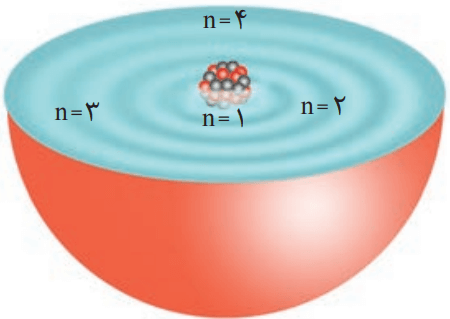
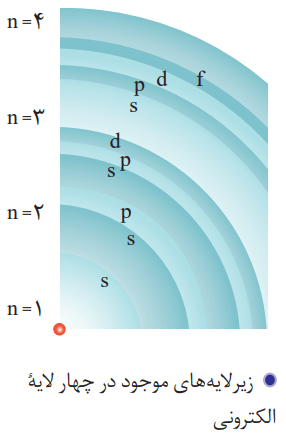
برای توجیه و علت ایجاد طیف نشری خطی دیگر عنصرها و چگونگی نشر نور از اتمها، ساختار لایهای اتم ارائه شد. در این مدل، اتم را کرهای در نظر میگیرند که هسته در فضایی بسیار کوچک و در مرکز آن قرار دارد. الکترونها هم در فضایی بسیار بزرگتر و در لایههایی پیرامون هسته توزیع میشوند. این لایهها را از هسته به سمت بیرون شمارهگذاری میکنند و شماره هر لایه را با n نمایش میدهند.
n، عدد کوانتومی اصلی نام دارد که برای لایه اول n=1، برای لایه دوم n=2، … و برای لایه هفتم n=7 است.
در ساختار لایهای اتم هر بخش پررنگ، مهمترین بخش از یک لایه الکترونی را نشان میدهد. بخشی که الکترونهای آن لایه، بیشتر وقت خود را در آن فاصله از هسته سپری میکنند. الکترون در هر لایهای که باشد، در همه نقاط پیرامون هسته حضور مییابد. با این حال، در محدوده یاد شده احتمال حضور بیشتری دارد.
کوانتومی بودن داد و ستد انرژی
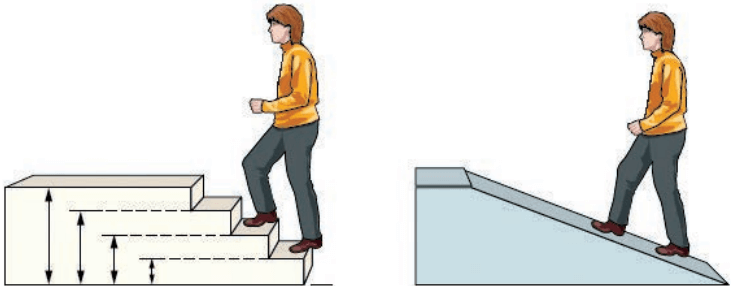
هنگام انتقال الکترون از یک لایه به لایه دیگر در ساختار لایهای اتم، داد و ستد انرژی به صورت کوانتومی است. الکترون در زمان انتقال از یک لایه به لایه دیگر، انرژی را به صورت پیمانهای یا بستههای معین، جذب یا نشر میکند. برای درک بهتر مفهوم کوانتومی بودن انرژی، تصور کنید برای رسیدن به بالای یک بلندی دو راه وجود دارد.
در راه اول میتوان از پلکان بالا رفت. میدانیم که برای این کار، باید پا روی هر پله گذاشت و با صرف انرژی، از یک پله به پله بالایی رفت. مسلما هرگز نمیتوان جایی میان دو پله ایستاد. برای بالا رفتن از هر پله، باید انرژی معین و کافی صرف کرد تا بدن را از آن پله به پله بعدی بالا بکشد. اگر انرژی به کار رفته کمتر از این مقدار انرژی باشد، دیگر نمیتوان به پله بالاتر رسید.
در راه دوم برای رسیدن به بالای سربالایی، باید از یک مسیر هموار بالا رفت. در این حالت دیگر مشکل راه اول وجود ندارد. هر لحظه و به هر اندازه میتوان بالا رفت یا هر جایی که ممکن است، ایستاد و به هر مقدار دلخواهی انرژی صرف کرد.
با این توصیف در میان این دو راه، هنگام بالا رفتن از پلکان محدودیت آشکاری وجود دارد.
مدل کوانتومی اتم
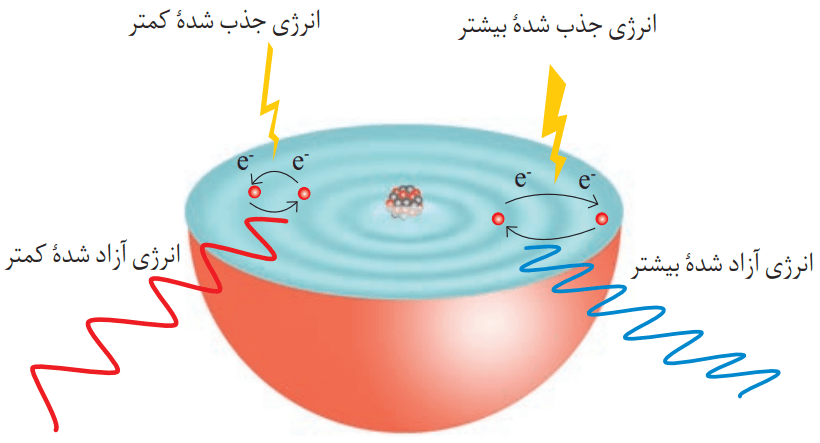
الکترونها در اتم برای گرفتن یا از دست دادن انرژی هنگام انتقال بین لایهها، محدودیتی مانند مثال پلکان را دارند. از طریق تابش نور یا گرم کردن، میتوان به اتمهای گازی یک عنصر انرژی منتقل کرد. در این صورت الکترونها با جذب انرژی معین از لایهای به لایه بالاتر انتقال مییابند. هر چقدر مقدار انرژی جذب شده بیشتر باشد، الکترونها به لایههای بالاتری انتقال مییابند.
در نتیجه جابجایی الکترون بین لایهها، انرژی با طول موج معین جذب یا نشر میشود.
با این توصیف انرژی داد و ستد شده هنگام انتقال الکترونها در اتم، کوانتومی است. این انرژی در پیمانههای معینی، جذب و یا نشر میشود. از این رو به چنین ساختاری برای اتم، مدل کوانتومی اتم میگویند.
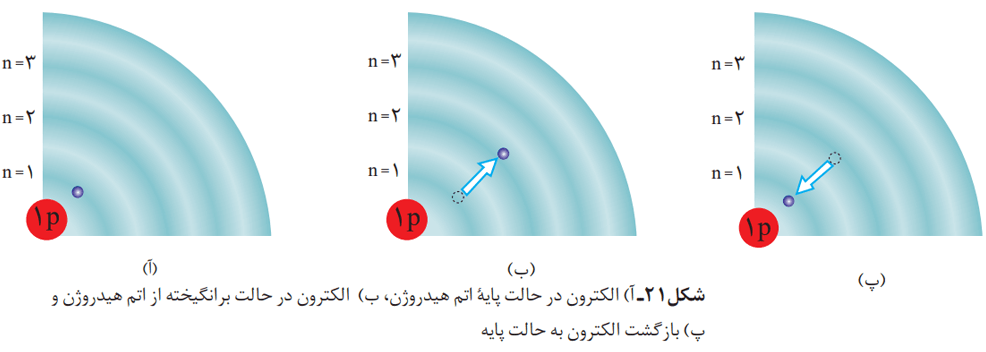
بر اساس این مدل، الکترونها در هر لایه، آرایش و انرژی معینی دارند و اتم از پایداری نسبی برخوردار است. این پایداری به نحوی است که میتوان گفت اتم، در حالت پایه قرار دارد. در این ساختار، انرژی الکترونها در اتم با افزایش فاصله از هسته افزایش پیدا میکند.
اتمهای برانگیخته
اگر به اتمها در حالت پایه انرژی داده شود، الکترونهای آنها با جذب انرژی به لایههای بالاتر انتقال مییابد. به اتمها در چنین حالتی، اتمهای برانگیخته میگویند.
اتمهای برانگیخته پر انرژی و ناپایدارند. به همین دلیل تمایل دارند دوباره با از دست دادن انرژی، به حالت پایدارتر و در نهایت به حالت پایه برگردند. مناسبترین شیوه برای از دست دادن انرژی برای الکترونها، نشر نور است. الکترونها در اتم برانگیخته، هنگام بازگشت به حالت پایه، نوری با طول موج معین نشر میکنند.
حال میتوان یک مورد را درباره هر نوار رنگی در طیف نشری خطی هر عنصر بیان کرد. هر نوار، پرتوهای نشر شده هنگام بازگشت الکترونها را از لایههای بالاتر به لایههای پایینتر نشان میدهد.
انرژی لایههای الکترونی پیرامون هسته هر اتم، ویژه همان اتم بوده و به عدد اتمی آن وابسته است. بنابراین انرژی لایهها و تفاوت انرژی میان آنها در اتم عنصرهای گوناگون، متفاوت است. انتظار میرود هر عنصر، طیف نشری خطی منحصر به فردی ایجاد کند.
با تعیین دقیق طول موج نوارهای یاد شده میتوان به تصویر دقیقی از انرژی لایههای الکترونی و در واقع آرایش الکترونی اتم دست یافت.
توزیع الکترونها در لایهها و زیرلایهها
عنصرها در جدول دورهای بر مبنای عدد اتمی یا شمار الکترونهای اتم خود، چیده میشوند. طبق این چینش اتم هیدروژن با یک الکترون و اتم هلیم با دو الکترون، اولین و دومین عناصر جدول هستند. این روند تا عنصر 118 جدول دورهای ادامه مییابد. در این روند اتم هر عنصر نسبت به اتم عنصر پیش از خود، یک الکترون بیشتر دارد.
میدانیم که اتم، ساختار لایهای دارد و الکترونها در لایههای پیرامون هسته با نظم ویژهای حضور دارند. در اتم عنصرهای ردیف اول، لایه الکترونی اول و در عنصرهای دوره دوم، لایه دوم از الکترون پر میشود. فکر میکنید میان شمار عنصرهای موجود در هر دوره و گنجایش لایههای الکترونی، چه رابطهای برقرار است؟
میبینید که در دوره اول فقط 2 عنصر (هیدروژن و هلیم) وجود دارد که در اتم آنها، لایه الکترونی اول (n=1) در حال پر شدن است. این لایه، نزدیکترین لایه به هسته است و تنها میتواند 2 الکترون را در خود جای دهد. متوجه شدیم که لایه اول حداکثر 2 الکترون گنجایش دارد. از این رو میتوان گفت که در دوره اول فقط 2 عنصر وجود دارد.
با نگاه به جدول میبینیم که اتم عنصرهای دوره دوم، دارای دو لایه الکترونی است (n=2). در اتم این عنصرها، هر دو لایه دارای الکترون هستند. الکترونها در لایه اول پر شدهاند و در لایه دوم، در حال پر شدن هستند. میتوانید بگویید که چرا لایه دوم حداکثر با 8 الکترون پر میشود؟ آیا میتوان بین چیدمان 8 عنصر دوره دوم در جدول و شیوه پر شدن لایه دوم در اتم آنها ارتباطی یافت؟ آیا لایه الکترونی دوم، لایهای یکپارچه است یا از چند بخش تشکیل شده است؟
با هم بیندیشیم صفحه 28
با هم بیندیشیم فصل اول شیمی دهم که در صفحه 28 کتاب درسی است، شامل 3 سوال میشود. در ادامه هر سوال را بررسی و پاسخ آن را میآوریم.
سوال 1
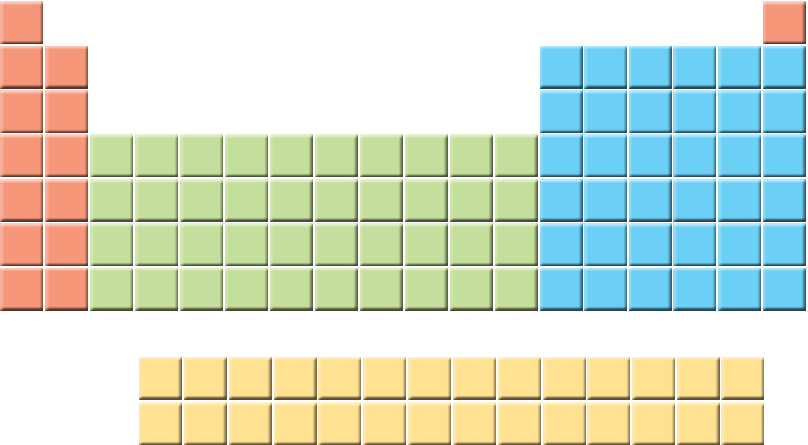
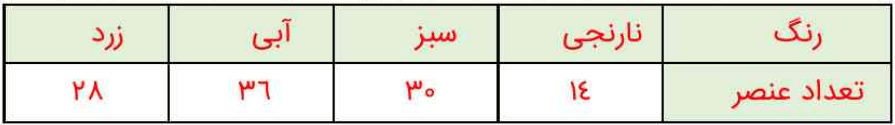
1- یک دانشجوی رشته شیمی، جدول دورهای را به دقت بررسی و عنصرهای هر دوره را شمارش کرد. او میان شمار عنصرهای یک دوره و شیوه پر شدن لایههای الکترونی در اتم عنصرها، ارتباطی کشف کرد. او نخست عنصرها را در چهار دسته قرار داد و هر یک را با رنگی مشخص کرد. پس از آن فرض نمود که هر لایه، خود از بخشهای کوچکتری تشکیل شده است. مطابق جدولی که در چند پاراگراف قبل دیدیم، او متوجه یک رابطه منطقی شد. این رابطه میان شمار عنصرها در هر دسته رنگی از هر ردیف، با گنجایش الکترونی هر یک از این بخشهای کوچکتر برقرار است.
آ) در هر دسته از عنصرهای نشان داده شده با رنگهای نارنجی، سبز، آبی و زرد در هر ردیف به ترتیب چند عنصر وجود دارد؟
ب) لایه دوم از چند بخش تشکیل شده است؟ گنجایش هر یک از این بخشها چند الکترون است؟
لایه دوم از دو بخش تشکیل شده است که دارای 2 و 6 الکترون هستند.
پ) او هر یک از این بخشها را یک زیرلایه نامید. با این توصیف، در اتم چند نوع زیرلایه وجود دارد و هر یک چند الکترون گنجایش دارد؟
در اتم 4 نوع زیرلایه با گنجایش (2 و 6 و 10 و 14) الکترونی وجود دارد.
سوال 2
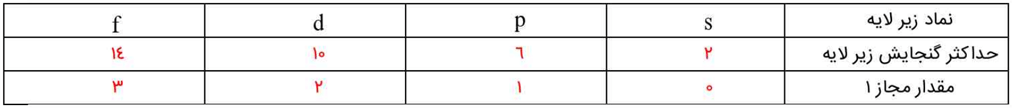
2- او گنجایش الکترونی زیرلایهها را به عنوان چهار جمله نخست یک دنباله به صورت زیر در نظر گرفت:
2, 6, 10, 14, ………….
آ) جمله عمومی (al) این دنباله را به دست آورید. (l⊇0)
al = 4l + 2
ب) مقدار مجاز l را برای هز زیرلایه تعیین و جدول زیر را کامل کنید.
جدولی که در کتاب درسی آمده است، به صورت زیر کامل میشود:
سوال 3
3- در مدل کوانتومی اتم به هر نوع زیرلایه، یک عدد کوانتومی نسبت میذهند. این عدد کوانتومی با نماد l نشان داده شده و عدد کوانتومی فرعی نام دارد. مقادیر معین و مجاز آن به صورت زیر است:
l = 0, 1, …… و n-1
آ) با این توصیف، جدول زیر را کامل کنید.
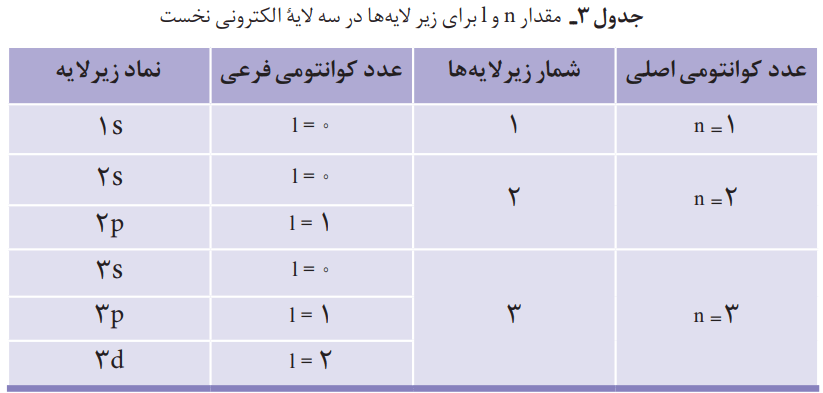
جدولی که در کتاب است را میتوان به صورت زیر کامل نمود:
ب) پیشبینی کنید پنجمین نوع زیرلایه یک اتم، ظرفیت پذیرش حداکثر چند الکترون را خواهد داشت؟
ظرفیت پذیرش زیرلایه پنجم (l=4) حداکثر 18 الکترون است. دلیل آن را در خط بعدی مشاهده کنید.
4l + 2 ⇒ 4 * 4 + 2 = 18 الکترون
مقدار n و l برای زیرلایهها
اتم را میتوان کرهای در نظر گرفت که هسته بسیار کوچک و سنگینی در مرکز آن قرار دارد که محل تمرکز پروتونها و نوترونهاست. پیرامون هسته، الکترونها در لایههای الکترونی حضور دارند.
هر لایه، خود از زیرلایههای متفاوتی تشکیل شده است.
لایه اول شامل یک زیرلایه از نوع s با گنجایش 2 الکترون میشود.
لایه دوم حاوی دو زیرلایه از نوع s و p است که گنجایش 2 و 6 الکترون را دارند.
آخرین لایه که لایه سوم میشود هم دارای سه زیرلایه از نوع p، s و d است. این زیرلایهها به ترتیب دارای گنجایش 2، 6 و 10 الکترون هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 1 شیمی 10، روی لینک های زیر کلیک کنید: