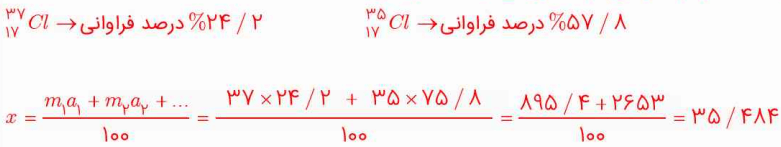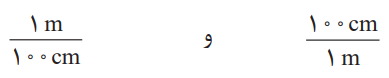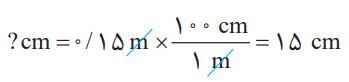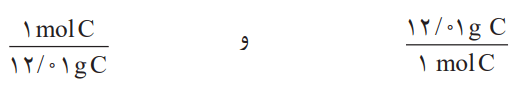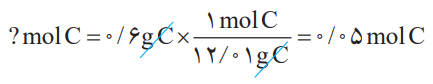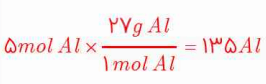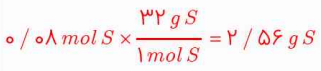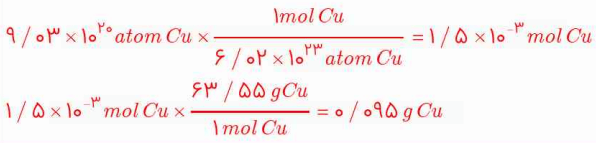آموزش جلسه 2 فصل 1 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
در جلسه قبل، با نحوه پیدایش عنصرها و مفاهیم پایداری و ایزوتوپ آشنا شدیم. این قسمت، نخست جرم اتمی عنصرها را قرار است بررسی میکنیم. در خلال این بررسی، با یکای جرم اتمی و جرم ذرههای زیر اتمی آشنا میشویم. موضوع بعدی به «شمارش ذرهها از روی جرم آنها» اختصاص دارد. در حین این موضوع، با مفاهیمی مانند جرم مولی و عامل تبدیل نیز آشنا خواهیم شد.
برای دسترسی به کل مباحث فصل اول، روی لینک زیر کلیک کنید.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل اول شیمی دهم جلسه 2
در این قسمت، بخشی از «آموزش جلسه دوم فصل اول شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی شیمی:
اگه تو هم میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ کافیه این فرم رو پر کنی و منتظر تماسمون باشی:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
جرم اتمی عنصرها؛ جلسه 2 فصل 1 شیمی دهم
جرم اجسام گوناگون را بنا بر اندازه و نوع آنها، با ترازوهای متفاوتی اندازهگیری میکنند.
عکس
جرم یک کامیون را با باسکول و یکای تن و جرم هنداونه را با ترازوی معمولی و یکای کیلوگرم اندازه میگیرند. برای بهدستآوردن جرم طلا، از ترازوهای دقیقتر با یکای گرم استفاده میکنند.
میشود گفت ترازوهایی که برای اندازهگیری جرم مواد گوناگون به کار میرود، دقت اندازهگیری متفاوتی دارند. دقت باسکولهای تنی تا یک صدم تن و دقت ترازوی زرگری، تا یک صدم گرم است. با استفاده از باسکول چند تنی، نمیتوان جرم یک هندوانه را اندازهگیری کرد؛ زیرا جرم هندوانه از دقت اندازهگیری این ترازو کمتر است.
یکای جرم اتمی
خواص فیزیکی و شیمیایی هر ماده را در محیطهایی مانند بدن انسان، محیط زیست، محیط آزمایش و … میشود بررسی و اثر آن را گزارش کرد. برای این کار لازم است بدانیم که چه جرمی از اتمها یا مولکولهای آن ماده، وارد محیط شده است. ازین رو دانشمندان همواره دنبال یافتن سنجهای مناسب و در دسترس، برای اندازهگیری جرم اتمها بودهاند.
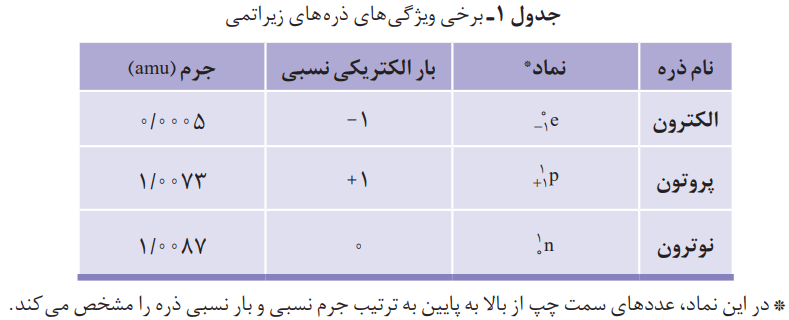
اتمها بسیار ریزند بهطوری که نمیتوان آنها را بهطور مستقیم مشاهده و جرم آنها را اندازهگیری کرد. دانشمندان بهخاطر همین مسائل، مقیاس جرم نسبی را برای تعیین جرم اتمها به کار میبرند. مطابق این مقیاس، جرم اتمها را با وزنهای میسنجند که جرم آن 1/12 جرم ایزوتوپ کربن_12 است. به این وزنه، یکای جرم اتمی (amu) میگویند.
ابتدا جرم یک ایزوتوپ کربن_12 را برابر با عدد 12 در نظر میگیریم. اگر این عدد را به 12 بخش یکسان تقسیم کنیم، هر بخش را 1amu مینامند. با کمک مقیاسی که به دست میآید، میتوان جرم همه اتمها را اندازهگیری کرد. اگر در ترازوی فرضی به جای ایزوتوپ کربن_12، اتم هیدروژن قرار گیرد، جرم 1.008amu به دست میآید.
جرم ذرههای زیر اتمی
با تعریف amu، شیمیدانها موفق شدند جرم اتمی دیگر عنصرها و همچنین جرم ذرههای زیر اتمی را اندازهگیری کنند. در این مقیاس جرم پروتون و نوترون، در حدود 1amu است. این در حالی است که جرم الکترون ناچیز و در حدود 1/2000amu است.
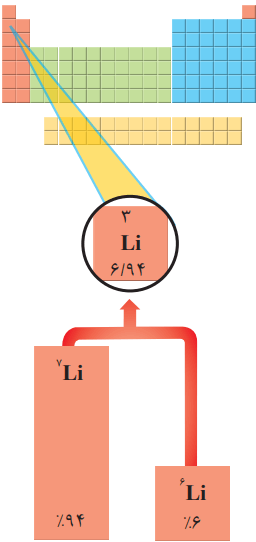
با این توصیف، جرم اتم 73Li را میتوان 7amu در نظر گرفت.
با هم بیندیشیم صفحه 15
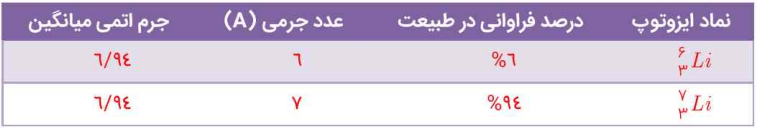
1- با توجه به شکل، به پرسشهای زیر پاسخ دهید.
آ) جدول زیر را کامل کنید.
با توجه به شکل بالا، جدول به این صورت کامل میشود.
ب) جرم اتمی میانگین هر عنصر، همان جرم نشان داده شده در جدول دورهای عنصرهاست. رابطهای بین جرم اتمی میانگین، درصد فراوانی و جرم اتمی ایزوتوپها بنویسید.
2- شکل پایین، ایزوتوپهای کلر را نشان میدهد.
آ) جرم اتمی میانگین کلر را حساب کنید.
کلر دارای دو ایزوتوپ است که با توجه به نمودار دایرهای، درصد فراوانی آنها به صورت زیر است:
ب) جرم اتمی میانگین به دست آمده را با جرم اتمی کلر در جدول دورهای مقایسه کنید.
جرم اتمی محاسبه شده با فرمول، مقداری کمتر از مقدار موجود در جدول تناوبی است.
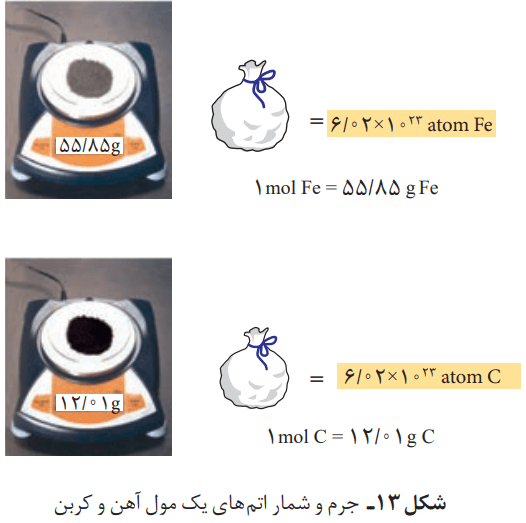
شمارش ذرهها از روی جرم آنها
فکر میکنید شمردن دانههای خاکشیر یا برنج موجود در یک نمونه کوچک، چقدر زمان میبرد؟ پس از این کار، تا چه حد از نتیجه شمارش اطمینان دارید؟ راهکار شما برای شمردن دانههای برنج یا خاکشیر در یک کیسه از این مواد چیست؟
با هم بیندیشیم صفحه 16
آ) جدول زیر را کامل کنید.
جدول موجود در کتاب درسی، به شکل زیر کامل میشود.
ب) به نظر شما جرم یک عدد از کدام ماده را میتوان با ترازوی دیجیتالی اندازهگیری کرد؟ چرا؟
کاغذ آچار، زیرا جرم یک عدد کاغذ آچار، در حد گرم است. از طرف دیگر، دقت ترازوی دیجیتالی هم در حد گرم است.
پ) روشی برای اندازهگیری جرم یک دانه خاکشیر ارائه کنید.
در ابتدا با یک ترازوی دیجیتالی، باید یک گرم از این ماده را وزن کرد. پس از آن با شمارش دانهها و تقسیم جرم بر تعداد دانه، جرم یک دانه خاکشیر به دست میآید.
ت) آیا جرم هر یک از دانههای برنج موجود در نمونه، با جرم به دست آمده در ستون چهارم جدول برابر است؟ توضیح دهید.
خیر، زیرا جرم هر یک از دانههای برنج به اندازه و ابعاد آن دانه وابسنه است.
اتمها بهطور باورنکردنی ریز هستند و نمیتوان با هیچ دستگاهی و حتی با شمردن تکتک آنها، شمارشان را بهدست آورد. با این حال میدانیم که از روی جرم یک نمونه ماده، میتوان به شمار واحدهای موجود در آن دست یافت. این الگو نشان میدهد که چگونه میتوان شمار اتمهای موجود در یک نمونه عنصر را تعیین کرد.
جرم مولی
در زندگی روزانه برای بیان شمارش، از یکاهای گوناگونی استفاده میشود. مثلا استفاده از شانه برای تخممرغ و دست برای قاشق و چنگال، شمارش و محاسبه را آسانتر میکند.
نقش NA در شیمی، مانند نقش شانه در شمارش تخممرغهاست؛ با این تفاوت چشمگیر که عدد آووگادرو، عدد بسیار بزرگی است. شیمیدانها به 1023 * 6.02 از هر ذره، یک مول از آن ذره میگویند. بنا بر تعریف، به جرم یک مول ذره بر حسب گرم، جرم مولی میگویند.
گرم، رایجترین یکای اندازهگیری جرم در آزمایشگاه شناخته میشود. این در حالی است که یکای جرم اتمی، یکای بسیار کوچکی برای جرم به شمار میآید. کار با این یکا در آزمایشگاه و در عمل، ناممکن است.
عامل (کسر) تبدیل
با استفاده از همارزی میان کمیتها، میتوان آنها را به یکدیگر تبدیل کرد. این امر به گونهای است که برای هر همارزی، میتوان دو عامل (کسر) تبدیل نوشت. در این عاملها، صورت و مخرج هر یک شامل عددی همراه با یکاست. مثلا از همارزی 1m = 100cm میتوان این دو عامل تبدیل را نوشت:
از این عاملها میتوان در تبدیل متر به سانتیمتر و برعکس استفاده کرد؛ برای نمونه به تبدیل 0.15 متر به سانتیمتر توجه کنید:
به همین ترتیب برای 1mol C = 12.01 g C، میتوان دو عامل تبدیل به صورت زیر نوشت:
بنابراین برای تبدیل جرم 0.6 گرم کربن به مولهای آن میتوان نوشت:
خود را بیازمایید صفحه 19
1- با استفاده از 1mol Al = 27g Al و 1mol S = 32g S حساب کنید:
آ) 5 مول آلومینیوم، چند گرم جرم دارد؟
ب) 0.08 گرم گوگرد، چند مول گوگرد است؟
2- دانشآموزی برای تعیین شمار اتمهای موجود در 0.2 مول فلز روی، محاسبه زیر را به درستی انجام داده است. هر یک از جاهای خالی را پر کنید.
3- حساب کنید 1020 * 9.03 اتم مس، چند مول و چند گرم مس است؟
فرم دریافت آموزش های ویدئویی شیمی:
اگه تو هم میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ کافیه این فرم رو پر کنی و منتظر تماسمون باشی:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 1 شیمی 10، روی لینک های زیر کلیک کنید: