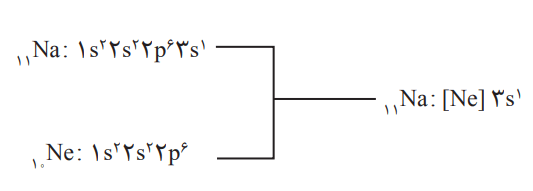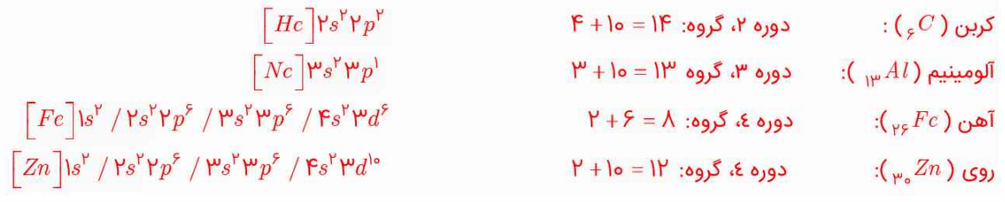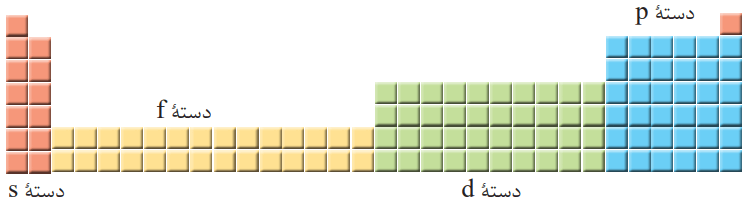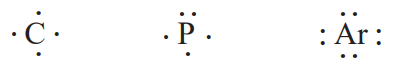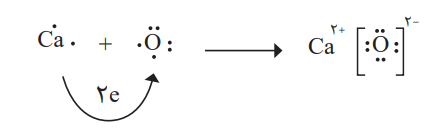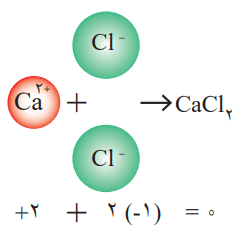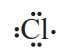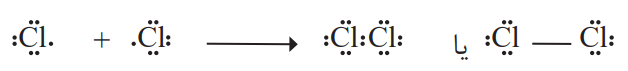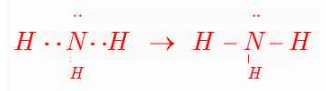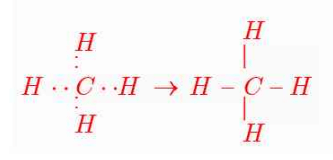آموزش جلسه 4 فصل 1 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
در مطلب قبلی با طیف سنج و طیف نشری تا ساختار اتم و توزیع الکترونها آشنا شدیم. قرار است در این قسمت بهصورت دقیق به آرایش الکترونی اتم و نحوه تبدیل آن به یون و مولکول بپردازیم.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل اول شیمی دهم جلسه 4
در این قسمت، بخشی از «آموزش جلسه چهارم فصل اول شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
در ابتدا با قاعده آفبا و آرایش الکترونی فشرده آشنا میشویم. پس از آن ساختار اتم و رفتار آن را از طریق آرایش الکترون-نقطهای بررسی میکنیم. دو مبحث بعدی، به نحوه تبدیل اتمها به یونها و مولکولها اختصاص دارد.
آرایش الکترونی اتم؛ جلسه 4 فصل 1 شیمی دهم
رفتار و ویژگیهای هر اتم را میتوان از روی آرایش الکترونی آن توضیح داد. میشود نتیجه گرفت که یافتن آرایش درست الکترونها در هر اتم، اهمیت زیادی دارد. مطابق مدل کوانتومی برای به دست آوردن آرایش الکترونی اتمها، یک قاعده وجود دارد. طبق این فاعده باید الکترونهای اتم هر عنصر در زیرلایهها با نظم و ترتیب معینی توزیع شوند.
قاعده آفبا
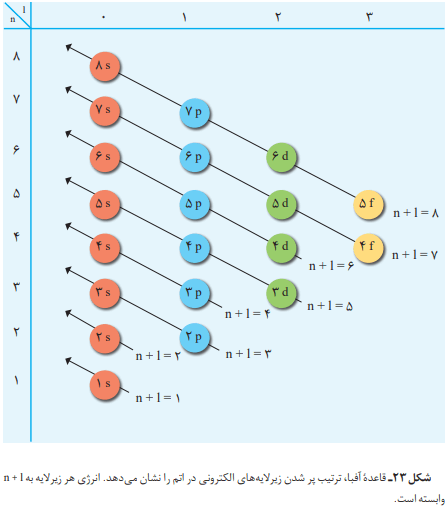
هنگام پرشدن اتم از الکترون، نخست زیرلایه 1s و سپس زیرلایههای 2s و 2p از الکترون پر میشود. بنابراین باید در اتم عنصرهای دوره سوم زیرلایههای 3p، 3s و 3d پر شود. طبق این روند انتظار میرود که این دوره شامل 18 عنصر باشد؛ ولی دوره سوم، دارای 8 عنصر است. در این اتمها تنها دو زیرلایه 3s و 3p در حال پرشدن است و زیرلایه 3d در دوره بعد شروع به پرشدن میکند. با این حساب متوجه میشویم که پرشدن زیرلایهها تنها به عدد کوانتومی اصلی (n) وابسته نیست. این روند، از یک قاعده کلی به نام قاعده آفبا پیروی میکند.
قاعده آفبا؛ ترتیب پرشدن زیرلایهها را در اتمهای گوناگون نشان میدهد. این قاعده، روند افزودن الکترون به زیرلایهها را بهصورتی منطقی توجیه میکند. در ابتدا زیرلایههای نزدیکتر به هسته پر میشوند که دارای انرژی کمتری هستند. پس از آن به ترتیب، زیرلایههای بالاتر پر خواهند شد.
انرژی زیرلایهها به n و n+l وابسته است. اگر n+l برای دو یا چند زیرلایه یکسان باشد، زیرلایه با n بزرگتر، انرژی بیشتری دارد.
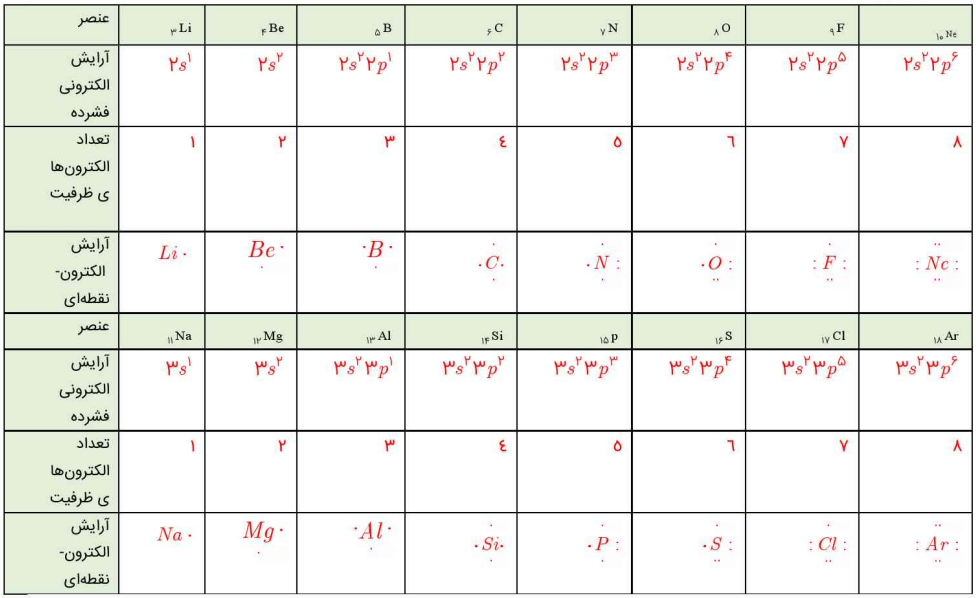
بر این اساس، آرایش الکترونی اتم بریلیم (Z=4)، اتم سدیم (Z=11)، اتم فسفر (Z=15)، اتم کلسیم (Z=20) و اتم تیتانیم (Z=22) بهصورت زیر خواهد بود:
4Be : 1s2 2s2
11Na : 1s2 2s2 2p6 3s1
15P : 1s2 2s2 2p6 3s2 3p3
20Ca : 1s2 2s2 2p6 3s2 3p6 4s2
22Ti : 1s2 2s2 2p6 3s2 3p6 3d2 4s2
قاعده آفبا آرایش الکترونی اتم اغلب عنصرها را به درستی پیشبینی میکند. با این حال برای اتم برخی عنصرهای جدول، نارسایی دارد. با کمک روشهای طیفسنجی پیشرفته، آرایش الکترونی چنین اتمهایی را میتوان با دقت تعیین کرد.
خود را بیازمایید صفحه 32
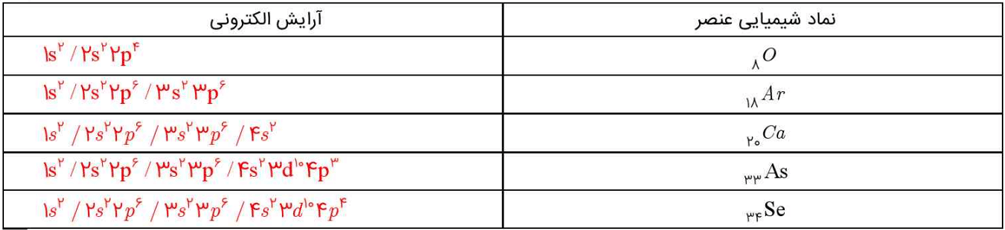
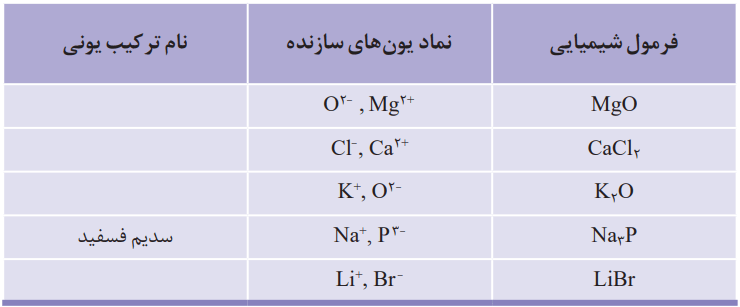
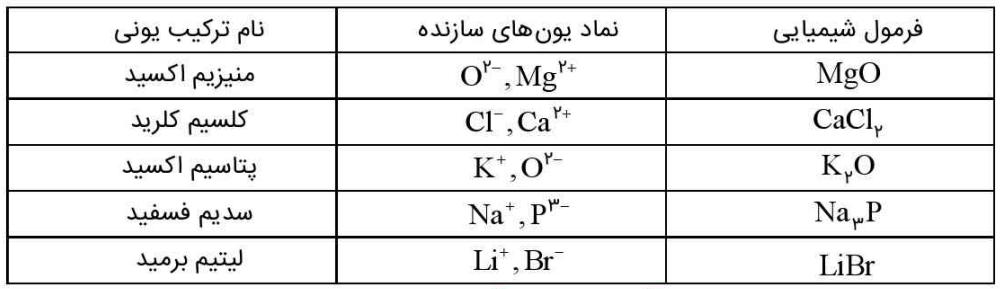
1- آرایش الکترونی اتمهای داده شده را در جدول زیر بنویسید.
جدولی که در کتاب درسی آمده است، به صورت زیر پر میشود:
2- دادههای طیفسنجی نشان میذهد که آرایش الکترونی برخی اتمها از قاعده آفبا پیروی نمیکند. مثلا هر یک از اتمهای کروم و مس، در بیرونیترین زیرلایه خود تنها یک الکترون دارد. آرایش الکترونی این دو اتم را رسم کنید.
آرایش الکترونی اتم کروم و مس بهصورت زیر است:
24Cr : 1s2 / 2s2 2p6 / 3s2 3p6 / 4s1 3d5
29Cu : 1s2 / 2s2 2p6 / 3s2 3p6 / 4s1 3d10
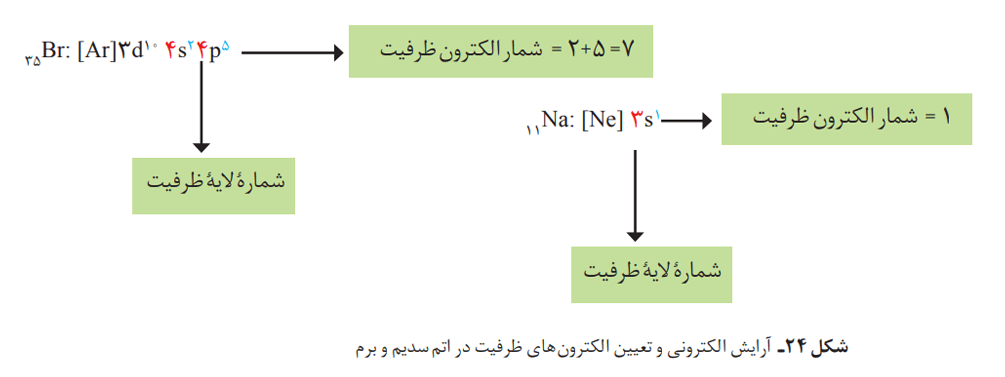
آرایش الکترونی فشرده و لایه ظرفیت
آرایش الکترونی اتمها را میتوان به شیوه دیگری هم نوشت که آرایش الکترونی فشرده نام دارد. در پایین میتوانید آرایش الکترونی فشرده برای اتم سدیم را مشاهده کنید:
11Na : [Ne] 3s1
اگر دقت کنید میبینید که در این آرایش الکترونی، از نماد گاز نجیب استفاده شده است. برای دستیابی به آرایش فشرده، نخست آرایش اتم مورد نظر بهصورت گسترده نوشته میشود. سپس بررسی میکنیم که کدام بخش از آرایش الکترونی، همانند آرایش الکترونی یک گاز نجیب است. این بخش را با عبارت [نماد شیمیایی گاز نجیب] جایگزین میکنیم.
اهمیت این آرایش، به دلیل نمایش آرایش الکترونها در بیرونیترین لایه به نام لایه ظرفیت اتم است. لایه ظرفیت یک اتم، لایهای است که الکترونهای آن، رفتار شیمیایی اتم را تعیین میکند. به الکترونهای این لایه، الکترونهای ظرفیت اتم میگویند.
در عنصرهای دسته d از دوره چهارم، الکترونهای ظرفیت شامل الکترونها در زیرلایههای 4s و 3d است.
خود را بیازمایید صفحه 33
این خود را بیازمایید، شامل سه سوال میشود که در ادامه به بررسی آنها میپردازیم. بعد از هر سوال هم، پاسخ آن را میتوانید مشاهده کنید.
سوال 1
اولین سوال، خود به سه بخش تقسیم میشود که دو بخش آن، دارای جدول است.
آ) با مراجعه به جدول دورهای عنصرها، جدول زیر را کامل کنید.
این جدول، به صورت زیر کامل میشود:
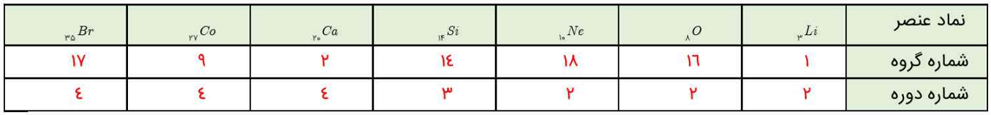
جواب جدول سوال 1 بخش آ خود را بیازمایید صفحه 33 شیمی دهم
ب) جدول زیر را کامل کنید.
جدول موجود در کتاب درسی را میتوان به شکل زیر کامل نمود:
پ) از روی آرایش الکترونی اتم هر عنصر، میتوان موقعیت آن را در جدول تعیین کرد. برای این منظور:
- شماره بیرونیترین لایه را با شماره دوره این عنصرها مقایسه کنید. از این مقایسه چه نتیجهای میگیرید؟
شماره دوره، همان شماره لایه ظرفیت است. عناصری که آرایش الکترونی آنها به (3d) ختم میشود، در دوره چهارم جای دارند.
- شماره گروه کدام عنصرها، با شمار الکترونهای ظرفیت آنها برابر است؟
سه عنصر این شرایط را دارند:
27Co , 20Ca , 3Li
- شماره گروه کدام عنصرها، با شمار الکترونهای ظرفیت آنها برابر نیست؟ در این حالت بین شماره گروه و شمار الکترونهای ظرفیت چه رابطهای هست؟ توضیح دهید.
عناصری که زیرلایه (s و d) آنها در حال پرشدن است، شماره گروه با تعداد الکترونهای ظرفیتی آنها برابر است.
در عناصری که زیرلایه (p) آنها در حال پرشدن است، یک ترفند را میتوان به کار برد. با اضافه کردن عدد 10 بر تعداد الکترونهای ظرفیتی، میتوان به شماره گروه این عناصر پی برد.
- برای عنصرهای دسته d، شماره دوره و گروه را چگونه میتوان از روی آرایش الکترونی به دست آورد؟ توضیح دهید.
عناصر دسته (d) دارای شماره دوره (n+l) هستند. مثلا اگر آرایش الکترونی زیرلایه به 3d7 ختم شود، دوره آن، (4=1+3) میشود. برای به دست آوردن شماره گروه میتوان تعداد الکترون ظرفیت را منظور کرد. این امر برای عناصر کروم و مس کاربرد ندارد. این دو عنصر، آرایش الکترونی استثنا دارند و به ترتیب، در گروههای 6 و 11 جدول تناوبی جای دارند.
سوال 2
موقعیت عنصرهای کربن (6C)، آلومینیوم (13Al)، آهن (26Fe) و روی (30Zn) را در جدول دورهای عنصرها تعیین کنید.
سوال 3
عنصرهای جدول دورهای را میتوان در چهار دسته به صورت زیر جای داد.
اساس این دستهبندی را توضیح دهید.
عناصر جدول تناوبی در چهار دسته p، d، f و s قرار میگیرند. طبق اصل آفبا، بر اساس آرایش الکترونی لایه ظرفیت و بیرونیترین زیرلایه، اتمها را در دوره و گروههای مشخص طبقهبندی میکنند. عناصری که در هر گروه از جدول قرار دارند، دارای آرایش الکترونی لایه ظرفیت مشابهی هستند.
ساختار اتم و رفتار آن
از مدتها پیش شیمیدانها پی بردند که گازهای نجیب در طبیعت، به شکل تک اتمی یافت میشوند. این واقعیت بیانگر این است که این گازها واکنشناپذیر بوده یا واکنشپذیری بسیار کمی دارند، از این رو پایدارند. فکر میکنید بین آرایش الکترونی این اتمها، پایداری و واکنشناپذیری آنها رابطهای وجود دارد؟ برای پاسخ به این پرسش، در ابتدا آرایش الکترونی چهار گاز نجیب را ببینید:
2He : 1s2
10Ne : [He] 2s2 2p6
18Ar : [Ne] 3s2 3p6
36Kr : [Ar] 3d10 4s2 4p6
در لایه ظرفیت این اتمها، هشت الکترون وجود دارد (به جز هلیم که در تنها لایه الکترونی خود، دو الکترون دارد). بنابراین میتوان نتیجه گرفت که بین پایداری و آرایش الکترونی لایه ظرفیت اتمها، باید رابطهای باشد. اگر لایه ظرفیت اتمی همانند آرایش الکترونی یک گاز نجیب یا هشت تایی باشد، آن اتم واکنشپذیری چندانی ندارد. به عبارت دیگر اگر لایه ظرفیت اتمی چنین نباشد، آن اتم واکنشپذیر است.
آرایش الکترون-نقطهای
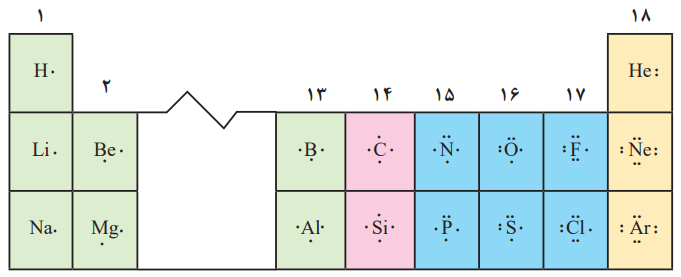
لوویس برای توضیح و پیشبینی رفتار اتمها، آرایشی به نام آرایش الکترون-نقطهای را ارائه کرد. در این آرایش الکترونهای ظرفیت هر اتم، پیرامون نماد شیمیایی آن با نقطه نمایش داده میشود. مثلا آرایش الکترون-نقطهای سدیم بهصورت .Na است.
برای رسم آرایش الکترون-نقطهای هر اتم، میتوان نقطهگذاری را از یک سمت مانند سمت راست نماد شیمیایی عنصر آغاز کرد. پس از آن نقطههای بعدی در زیر، سمت چپ و بالای آن قرار میگیرد. الکترون پنجم و پس از آن را باید طوری پیرامون نماد شیمیایی عنصر قرار داد که هر یک، بهصورت جفت نقطه درآید. در قسمت پایین، آرایش الکترون-نقطهای اتمهای کربن، فسفر و آرگون را میتوانید مشاهده کنید.
خود را بیازمایید صفحه 35
آ) جدول زیر را کامل کنید.
جدول کتاب شیمی، بهصورت زیر کامل میشود.
ب) آرایش الکترون-نقطهای اتم عنصرهای یک گروه چه شباهتی دارد؟ توضیح دهید.
عناصری که در یک گروه قرار دارند، دارای آرایش الکترون نقطهای مشابهی هستند. برای مثال آرایش الکترون-نقطهای Si و C مشابه همدیگر است.
پ) بین شماره گروه و آرایش الکترون-نقطهای چه رابطهای وجود دارد؟ توضیح دهید.
گروه 1 و 2 به ترتیب دارای 1 و 2 الکترون ظرفیت هستند. گروههای 13 تا 18 با در نظر گرفتن شمارههای یکان آنها، دارای 3 و 8 الکترون ظرفیت هستند. بنابراین اتمهای این گروهها، هنگام رسم آرایش، 3 تا 8 نقطه در اطراف خود دارند.
رفتار شیمیایی اتم
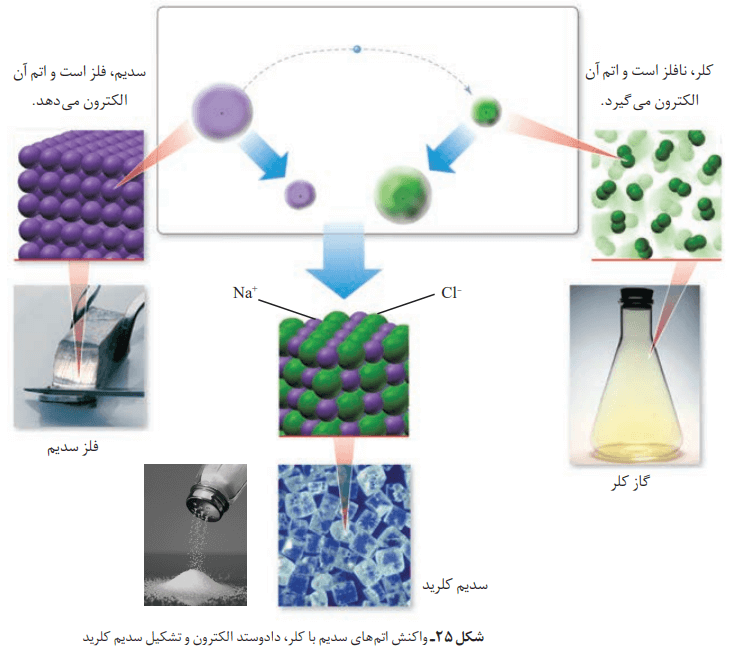
رفتار شیمیایی هر اتم به شمار الکترونهای ظرفیت آن بستگی دارد؛ طوری که میتوان دستیابی به آرایش گاز نجیب را مبنای رفتار آنها دانست. اتمها میتوانند الکترونهای خود را از دست بدهند یا بر تعداد آنها اضافه کنند. علاوه بر این، قابلیت به اشتراک گذاشتن الکترونها را هم دارند. اتمها با این روشها قابلیت رسیدن به آرایش یک گاز نجیب یا هشت تایی شدن را دارند تا پایدارتر گردند. اگر اتمهای سدیم و کلر کنار یکدیگر قرار بگیرند، واکنش نشان میدهند. اتم سدیم با از دست دادن یک الکترون به یون سدیم و اتم کلر با گرفتن یک الکترون، به یون کلرید تبدیل میشود. نتیجه واکنش این دو اتم، تولید سدیم کلرید یا همان نمک خوراکی است.
همانطور که در عکس میبینیم، جفت اتمها میخواهند به آرایش یک گاز نجیب برسند. اتمهای سدیم با از دست دادن الکترون به آرایش پایدار گاز نجیب پیش از خود (نئون) میرسند. در این واکنش اتمهای کلر هم با گرفتن الکترون به آرایش پایدار گاز نجیب هم دوره خود (آرگون) میرسند.
با هم بیندیشیم صفحه 37
این با هم بیندیشیم، دارای سه سوال است که در اولین سوال، با دو جدول مواجه هستیم.
سوال 1
جدول زیر را در نظر بگیرید:
آ) آرایش الکترون-نقطهای اتمهای داده شده را با اتم گازهای نجیب، مقایسه کنید. پس از آن، پیشبینی کنید هر یک از این اتمها در واکنشهای شیمیایی چه رفتاری خواهد داشت؟
آرایش الکترون-نقطهای گازهای نجیب، هشت تایی است.
با توجه به تعداد الکترونهای تکی میتوان پیشبینی کرد که هر یک اتم، چند اتصال یا پیوند میتواند برقرار کند. مثلا گروه (16) دارای 2 تک الکترون است و میتواند 2 پیوند تشکیل دهد. همچنین اتمهای این گروه میتوانند با دریافت 2 الکترون، به آرایش الکترونی گاز نجیب بعد از خود برسند.
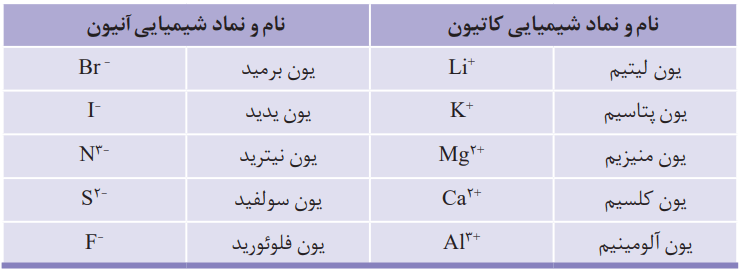
ب) بررسیها نشان میدهد که اغلب این اتمها در طبیعت بهصورت یون در ترکیبهای گوناگون یافت میشود. جدول زیر یونهای شناختهشده از این اتمها را نشان میدهد. اکنون با توجه به آن، درستی پیشبینیهای خود را بررسی کنید.
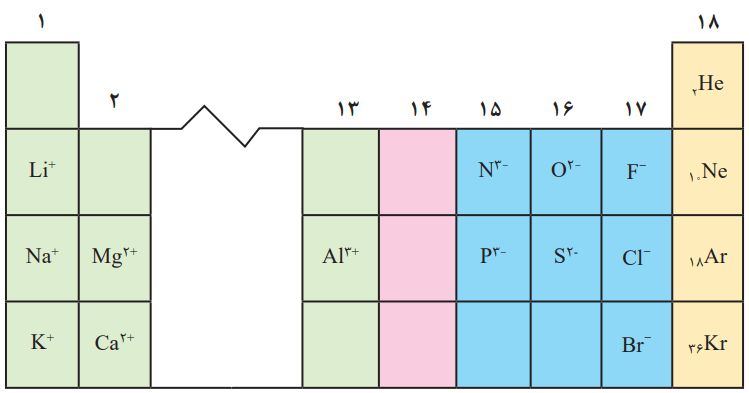
عناصر فلزی (گروههای 1، 2 و 3) الکترون از دست میدهند و به آرایش گاز نجیب قبل خود میرسند.
عناصر نافلزی (گروههای 15 تا 17) با گرفتن الکترون به آرایش الکترونی گاز نجیب بعد از خود میرسند.
در گروه 14، عناصر به طور معمول با اشتراک گذاشتن الکترون به پایداری میرسند.
سوال 2
با توجه به جدول در هر مورد با خط زدن واژه نادرست، عبارت داده شده را کامل کنید.
جوابهای درست را با رنگ قرمز، مشخص کردهایم.
آ) اگر تعداد الکترونهای ظرفیت اتمی کمتر یا برابر با (سه/چهار) باشد، آن اتم در شرایط مناسب تمایل دارد که (تعدادی از/ همه) الکترونهای ظرفیت خود را از دست بدهد و به (کاتیون/ آنیون) تبدیل شود.
ب) اتم عنصرهای گروه 1 و 2 در شرایط مناسب با (از دست دادن/ گرفتن) الکترون به (کاتیون/ آنیون) تبدیل میشوند که آرایشی همانند آرایش الکترونی گاز نجیب (پیش/ پس) از خود را دارند.
پ) اتم عنصرهای گروه 15، 16 و 17 در شرایط مناسب با (از دست دادن/ به دست آوردن) الکترون به (کاتیون/ آنیون) هایی تبدیل میشود که آرایشی همانند آرایش الکترونی گاز نجیب هم دوره خود را دارد.
سوال 3
پیشبینی کنید اتم هر یک از عنصرهایی که به ترتیب در خانههای شماره 7 و 12 جدول دورهای جای دارد، در شرایط مناسب به چه یونی تبدیل میشود؟
عنصر خانه (7) در گروه (15) قرار دارد. از این رو برای رسیدن به آرایش الکترونی گاز نجیب هم دوره پس از خود، 3 الکترون دریافت میکند و به یون X-3 تبدیل میشود.
عنصر خانه (12) در گروه (2) قرار دارد. این عنصر برای رسیدن به آرایش الکترونی گاز نجیب دوره قبل از خود، 2 الکترون از دست میدهد و به یون X+2 تبدیل میشود.
تبدیل اتمها به یونها
اتم اکسیژن برای رسیدن به آرایش گاز نجیب پس از خود، باید دو الکترون بگیرد. با این حال اتم کلسیم باید دو الکترون ظرفیت خود را از دست بدهد تا به آرایش پایدار گاز نجیب پیش از خود برسد. هرگاه اتمهای این دو عنصر در شرایط مناسب، کنار هم قرار گیرند، با هم واکنش میدهند. این دو عنصر با داد و ستد الکترون، به یونهای Ca+2 و O-2 تبدیل میشوند. میان یونهای تولید شده بارهای الکتریکی ناهمنام وجود دارد. بنابراین در بین آنها، نیزوی جاذبه بسیار قوی برقرار میشود. به این نیروی جاذبه قوی، پیوند یونی میگویند. ترکیب حاصل از این واکنش، کلسیم اکسید نام دارد که آن را با فرمول شیمیایی CaO نشان میدهند. از این فرمول دو نکته را میتوان متوجه شد. اول اینکه کلسیم و اکسیژن دو عنصر سازنده این ترکیباند و دوم، نسبت یونهای سازنده آن 1 به 1 است.
به ترکیبهایی مشابه کلسیم اکسید که ذرههای سازنده آنها یون است، ترکیب یونی میگویند.
یون تک اتمی
به کاتیون یا آنیونی که تنها از یک اتم تشکیل شده است، یون تک اتمی میگویند.
برای نمونه هر یک از یونهای +Na و –Cl، تک اتمی هستند.
ترکیب یونی دو تایی
هر ترکیب یونی که تنها از دو عنصر ساخته شده، ترکیب یونی دو تایی نام دارد. این ترکیبها میتوانند از واکنش فلزها با نافلزها پدید آیند.
فرمول شیمیایی کلسیم کلرید نشان میدهد که نسبت کاتیون به آنیون سازنده آن، 1 به 2 است.
با هم بیندیشیم صفحه 38
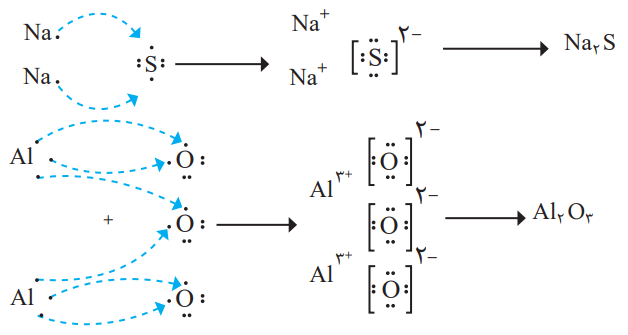
هر ترکیب یونی از لحاظ بار الکتریکی خنثی است؛ زیرا مجموع بار الکتریکی کاتیونها با مجموع بار الکتریکی آنیونها برابر است. از این ویژگی میتوان برای نوشتن فرمول شیمیایی ترکیبهای یونی دو تایی بهره برد. مثلا به چگونگی تشکیل سیدمسولفید و آلومینیماکسید و نوشتن فرمول شیمیایی آنها توجه کنید.
1- روشی برای نوشتن فرمول شیمیایی ترکیبهای یونی دو تایی ارائه کنید.
فلزها به تعداد الکترونهای ظرفیت خود، به نافلزها الکترون میدهند. در نتیجه، فلزها به کاتیون و نافلزها به آنیون تبدیل میشوند. در فرمول شیمیایی تعداد کاتیون و آنیونهای بهدست آمده را در اندیس (زیر) هرکدام قرار میدهیم. هنگام نوشتن فرمول شیمیایی، فلز در سمت راست و نافلز در سمت چپ قرار میگیرد.
2- فرمول شیمیایی هر یک از ترکیبهای زیر را بنویسید.
آ) کلسیم برمید ب) پتاسیم نیترید
پ) منیزیم سولفید ت) آلومینیم فلوئورید
فرمول شیمیایی چهار ترکیب بالا، مطابق جدول زیر است:
3- با توجه به دادههای جدول (آ)، شیوه نامگذاری ترکیبهای یونی دوتایی را مشخص و سپس جدول (ب) را کامل کنید.
جدول(آ)
جدول (ب)
ابتدا نام کاتیون را در سمت راست مینویسیم و سپس، نام آنیون را در کنار آن وارد میکنیم.
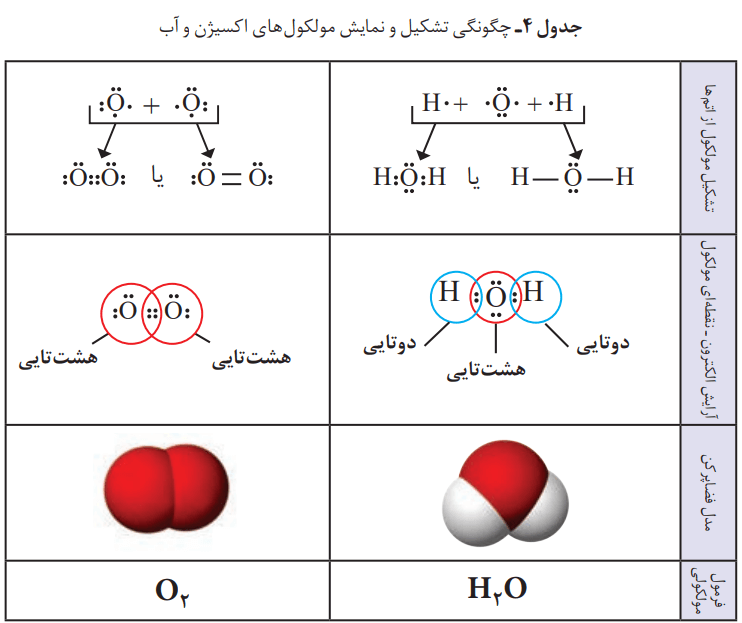
تبدیل اتمها به مولکولها
آیا همه اتمها هنگام ترکیب با یکدیگر، الکترون داد و ستد میکنند؟ بسیاری از ترکیبهای شیمیایی در ساختار خود هیچ یونی ندارند و ذرههای سازنده آنها، مولکولها هستند. به نظر شما، رفتار کدام اتمها سبب تشکیل مولکولها میشود؟ آیا تلاش برای رسیدن به آرایش هشت تایی، ملاکی برای رفتار اتمها هنگام تشکیل مولکول است؟
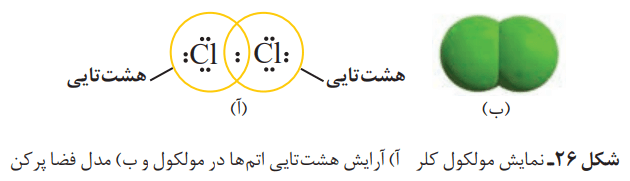
برای یافتن پاسخ این پرسشها، به آرایش الکترون-نقطهای اتم کلر نگاه کنید.
گاز کلر که خاصیت رنگبری و گندزدایی دارد، از مولکولهای دو اتمی (Cl2) تشکیل شده است. با توجه به آرایش الکترون-نقطهای اتم کلر، میتوان تشکیل این مولکول را بهصورت زیر نشان داد:
با این توصیف هر اتم کلر، تک الکترون خود را با دیگری به اشتراک میگذارد. در این اشتراک، دو الکترون موجود بین دو اتم در آرایش الکترون-نقطهای به هر دوی آنها تعلق دارد. در این وضعیت هر یک از اتمها به آرایش هشت تایی رسیده است.
جفت الکترون اشتراکی میان دو اتم کلر در مولکول Cl2، نشاندهنده یک پیوند اشتراکی (کووالانسی) است. این پیوند سبب اتصال دو اتم به یکدیگر در مولکول میشود.
اتم نافلزها در شرایط مناسب با تشکیل پیوندهای اشتراکی، میتوانند مولکولهای دو یا چند اتمی را بسازند.
مواد و فرمول مولکولی
مواد مولکولی؛ مواد شیمیایی خالصی هستند که در ساختار خود مولکول دارند.
به فرمول شیمیایی که افزون بر نوع عنصرهای سازنده، شمار اتمهای هر عنصر را در مولکول نشان میدهد، فرمول مولکولی میگویند.
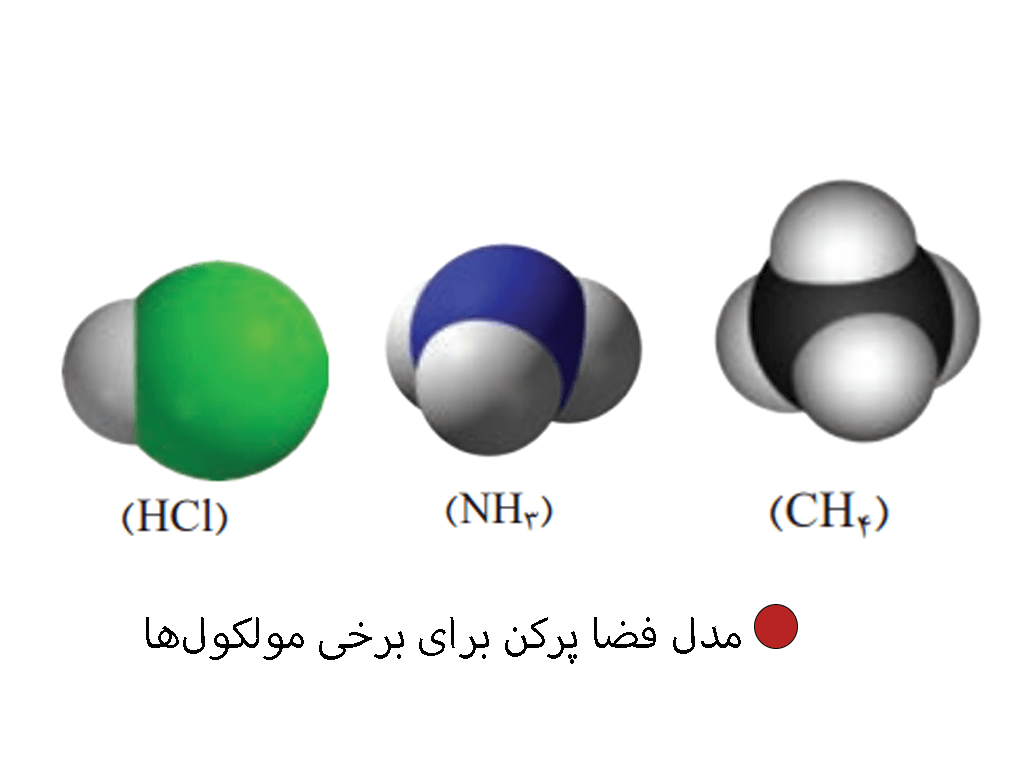
مدل فضا پر کن برخی مولکولها را در پایین میتوانید مشاهده کنید.
خود را بیازمایید صفحه 41
آرایش الکترون-نقطهای را برای هر یک از مولکولهای زیر رسم کنید.
آ) هیدروژن کلرید (HCl)
ب) آمونیاک (NH3)
پ) متان (CH4)
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 1 شیمی 10، روی لینک های زیر کلیک کنید: