آموزش جلسه 1 فصل 1 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
قسمت اول فصل یک شیمی دهم، پایه و اساس یادگیری سایر مباحث در طول سه سال تحصیلی است. با این حساب، باید بهطور ویژه روی آن تمرکز کنید و آموزش ببینید.
برای دسترسی به کل مباحث فصل اول، روی لینک زیر کلیک کنید.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل اول شیمی دهم جلسه 1
در این قسمت، بخشی از «آموزش جلسه اول فصل اول شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
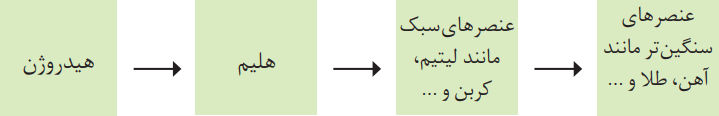
در ابتدا با هم بررسی میکنیم که عنصرها چگونه پدید آمدند. پس از آن با مفهوم پایداری اتمهای یک عنصر آشنا میشویم. در ادامه، درباره نخستین عنصر ساخت بشر اطلاعات کسب میکنیم. موضوع انتهایی نیز به کاربردهای رادیوایزوتوپ اختصاص دارد.
عنصرها چگونه پدید آمدند؟ جلسه 1 فصل 1 شیمی دهم
چگونگی پیدایش عنصرها، تنها یکی از پرسشهای مهمی است که شیمیدانها در پی یافتن پاسخ آن هستند. خوب است بدانید که مطالعه کیهان مخصوصا سامانه خورشیدی، کمک شایانی برای رسیدن به جواب میکند.
برای درک بهتر چگونگی تشکیل عنصرها، میتوان از یک روش قابل اطمینان استفاده کرد. این روش شامل بررسی نوع و مقدار عنصرهای سازنده برخی سیارههای سامانه خورشیدی و مقایسه آن، با عنصرهای سازنده خورشید است.
خود را بیازمایید صفحه 3
در شکل زیر میتوانید عنصرهای سازنده دو سیاره مشتری و زمین را ببینید. پس از مشاهده آن، به پرسشهای مطرح شده پاسخ دهید.
آ) فراوانترین عنصر در هر سیاره، کدام است؟
فراوانترین عنصر در زمین، آهن (Fe) و در مشتری، هیدروژن (H) است.
ب) عنصرهای مشترک در دو سیاره را نام ببرید.
اکسیژن (O) و گوگرد (S)
پ) در کدام سیاره، عنصر فلزی وجود ندارد؟
مشتری
ت) پیشبینی کنید سیازه مشتری بیشتر از جنس گاز است یا سنگ؟ چرا؟
از جنس گاز، زیرا بیشتر عناصر تشکیلدهنده آن نافلزی هستند.
ث) آیا به جز عنصرهای نشان داده شده در شکل، عنصرهای دیگری در زمین یافت میشود؟ چند نمونه نام ببرید.
بله؛ عناصری مانند کلسیم (Ca)، کبالت (Co) و پتاسیم (K) و …
مهبانگ، سرآغاز کیهان
تا اینجای کار فهمیدیم که نوع و میزان فراوانی عناصر در دو سیاره زمین و مشتری متفاوت است. در عین حال این دو سیاره، دارای عنصرهای مشترکی نیز هستند. این امر نشان میدهد که عنصرها بهصورت ناهمگون در جهان هستی توزیع شدهاند. از طریق این یافتهها دانشمندان توانستند چگونگی پیدایش عنصرها را توضیح دهند. برخی از آنها باور دارند که سرآغاز کیهان با انفجاری مهیب (مهبانگ) همراه بوده و طی آن، انرژی عظیمی آزاد شده است.
پس از پدید آمدن ذرههای زیر اتمی مانند الکترون، پروتون و نوترون، عنصرهای هیدروژن و هلیم برای اولین بار متولد شدند. با گذشت زمان و کاهش دما، گازهای هیدروژن و هلیم تولید شده، متراکم شد و مجموعههای گازی به نام سحابی ایجاد کرد. بعدها این سحابیها، سبب پیدایش ستارهها و کهکشانها شد.
تولد، رشد و مرگ ستارهها
درون ستارهها همانند خورشید در دماهای بسیار بالا، واکنشهای هستهای رخ میدهد. در این واکنشها از عنصرهای سبکتر، عنصرهای سنگینتر پدید میآیند. ستارهها مانند اغلب موجودات زنده متولد میشوند، رشد میکنند و سرانجام میمیرند. مرگ ستاره اغلب با یک انفجار بزرگ همراه است.
با مرگ و انفجار ستاره، عنصرهای تشکیلشده در آن، در فضا پراکنده میشود. از این رو میتوان ستارگان را کارخانه تولید عنصرها به حساب آورد.
واکنشهای هستهای خورشید
نزدیکترین ستاره به زمین که دمای بسیار بالایی دارد، خورشید است. خورشید، انرژی گرمایی و نور خیره کنندهای دارد. این امر به دلیل تبدیل هیدروژن به هلیم در واکنشهای هستهای است. در این واکنشها به طرز عجیبی، انرژی هنگفتی آزاد میشود.
انرژی آزاد شده در واکنش هستهای آنقدر زیاد است که میتواند صدها میلیون تن فولاد را ذوب کند. در پدیدههای طبیعی پیرامون ما و در زندگی روزانه نیز، واکنشهای شیمیایی رخ میدهند. از آنجا که مقدار انرژی مبادله شده بسیار کمتر است، نگرانی خاصی به وجود نمیآید.
آیا همه اتمهای یک عنصر پایدارند؟
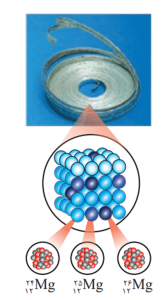
شیمیدانها مادهای را عنصر مینامند که از یک نوع اتم تشکیل شده باشد. مثلا منیزیم و هلیم عنصر به شمار میروند، زیرا یک نمونه منیزیم حاوی اتمهای منیزیم و یک نمونه هلیم، حاوی اتمهای هلیم است. بررسیها میگویند که اغلب در یک نمونه طبیعی از عنصری معین، اتمهای سازنده، جرم یکسانی ندارند. برای نمونه در مطالعهای، یک نمونه منیزیم را مورد بررسی قرار دادند. مشخص شد که جرم همه اتمهای منیزیم در این نمونه یکسان نیست، بلکه مخلوطی از سه هممکان (ایزوتوپ) است.
خود را بیازمایید صفحه 5
1- میدانید که هر عنصر را با نماد ویژهای نشان میدهند. در این نماد، شمار ذرههای زیر اتمی را نیز میتوان مشخص کرد. فرض کنید که اتمی از آهن 26 پروتون و 30 نوترون دارد. با توجه به الگوی زیر، مشخص کنید که Z و A هر کدام، چه کمیتی را نشان میدهد؟
نکته: نماد E، حرف نخست واژه Element به معنای عنصر است.
Z: عدد اتمی، نشانگر تعداد پروتونهای (p) یک اتم است.
A: عدد جرمی، نشانگر مجموع تعداد پروتون و نوترونهای (p+n) یک ماده است.
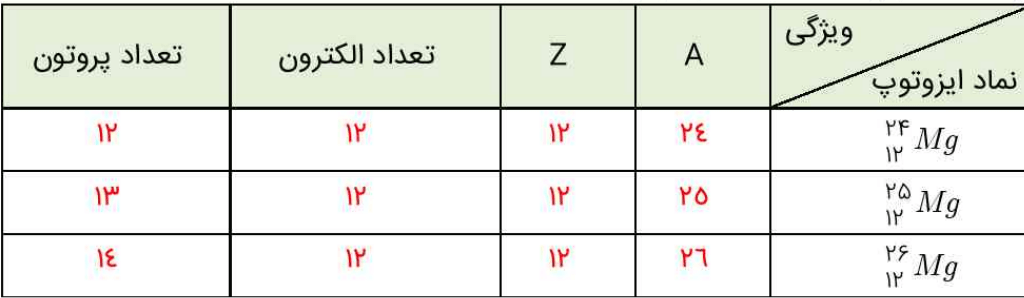
2- با توجه به نماد ایزوتوپهای منیزیوم، جدول را بهصورت زیر میتوان کامل کرد.
خواص شیمیایی و فیزیکی ایزوتوپها
ایزوتوپهای یک عنصر دارای Z یکسان، اما A متفاوت هستند. میتوان گفت که ایزوتوپها، اتمهای یک عنصرند که در شمار نوترونها با یکدیگر تفاوت دارند.
خواص شیمیایی اتمهای هر عنصر، به عدد اتمی (Z) آن وابسته است. از این رو اتمهای منیزیم همگی خواص شیمیایی یکسانی دارند و در جدول دورهای عنصرها، تنها یک مکان را اشغال میکنند. با این وجود همین ایزوتوپها در خواص فیزیکی وابسته به جرم، مانند چگالی با یکدیگر تفاوت دارند.
با هم بیندیشیم صفحه 6
این «با هم بیندیشیم» شیمی 10 که در صفحه 6 کتاب درسی است، دارای 2 سوال است. در ادامه سوالها و پاسخ آنها را میآوریم.
سوال 1 با هم بیندیشیم
1- دادههای جدول زیر را به دقت بررسی کنید؛ سپس به پرسشهای مطرح شده پاسخ دهید.
آ) چه شباهتها و چه تفاوتهایی میان این ایزوتوپها وجود دارد؟
عدد اتمی یکسان، ولی عدد جرمی متفاوتی دارند. خواص شیمیایی یکسان، ولی خواص فیزیکی متفاوتی دارند.
ب) یک نمونه طبیعی از عنصر هیدروژن، مخلوطی از چند ایزوتوپ است؟
ایزوتوپهایی که فراوانی آنها در طبیعت، بیشتر از صفر است. از آنجا که سه ایزوتوپ در طبیعت یافت میشود، بنابراین مخلوطی از 3 ایزوتوپ است.
پ) نیمعمر هر ایزوتوپ نشان میدهد که آن ایزوتوپ تا چه اندازه پایدار است. کدام ایزوتوپ هیدروژن از همه ناپایدارتر است؟
در بین ایزوتوپهای طبیعی، 31H از همه ناپایدارتر است. در ایزوتوپهای ساختگی که همگی ناپایدارند، 71H ناپایدارتر است.
ت) هسته ایزوتوپهای ناپایدار، ماندگار نیست و با گذشت زمان متلاشی میشود. این ایزوتوپها پرتوزا هستند. آنها اغلب بر اثر تلاشی افزون بر ذزههای پرانرژی، مقدار زیادی انرژی نیز آزاد میکنند. انتظار دارید چند ایزوتوپ هیدروژن پرتوزا باشند؟
در بین ایزوتوپهای طبیعی، 31H و در بین ایزوتوپهای ساختگی، همگی پرتوزا هستند. بنابراین، 5 ایزوتوپ هیدروژن پرتوزا هستند.
ث) اغلب هستههایی که نسبت شمار نوترونها به پروتونهای آنها برابر یا بیش از 1.5 باشد، ناپایدارند و با گذشت زمان متلاشی میشوند. چند ایزوتوپ هیدروژن دارای این ویژگی است؟
همه ایزوتوپهایی که عدد جرمی آنها، بزرگتر یا مساوی 3 است. (5 ایزوتوپ)
ج) اگر ایزوتوپهای پرتوزا و ناپایدار، رادیوایزوتوپ نامیده شود، چه تعداد از ایزوتوپهای هیدروژن، رادیوایزوتوپ به شمار میرود؟
جواب این سوال، دقیقا مشابه پاسخ پرسش قبلی است.
چ) درصد فراوانی هر ایزوتوپ در طبیعت، نشان دهنده چیست؟ توضیح دهید.
نشان دهنده پایداری آن ایزوتوپ است. هر چه درصد فراوانی یک ایزوتوپ در طبیعت بیشتر باشد، پایدارتر است.
سوال 2 با هم بیندیشیم
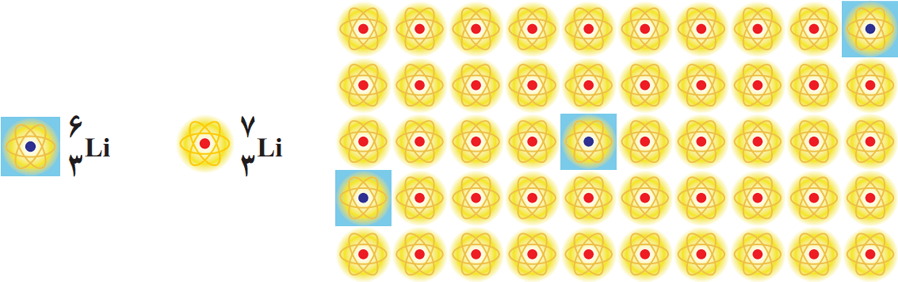
2- شکل زیر شمار تقریبی اتمهای لیتیم را در یک نمونه طبیعی از آن نشان میدهد. با توجه به آن، درصد فراوانی هر یک از ایزوتوپهای لیتیم را حساب کنید.
پاسخ:
تکنسیم، نخستین عنصر ساخت بشر
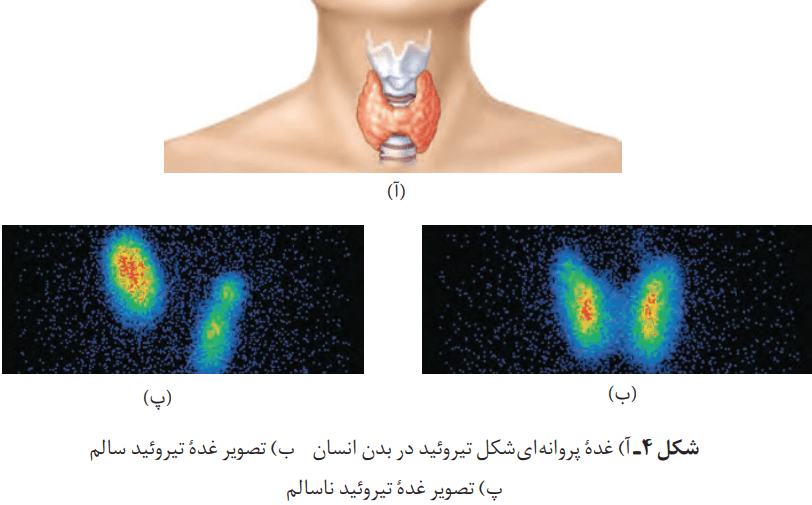
از 118 عنصر شناختهشده، تنها 92 عنصر در طبیعت یافت میشود؛ یعنی 26 عنصر دیگر ساختگی است. شیمیدانها با یافتن کاربردهای منحصر به فرد هر عنصر، انگیزه کافی برای ساختن عنصرهای جدید را داشتهاند. تکنسیم (9943Tc) نخسیتن عنصری بود که در واکنشگاه (راکتور) هستهای ساخته شد. این رادیوایزوتوپ در تصویربرداری پزشکی کاربرد ویژهای دارد.
از تکنسیم (9943Tc) برای تصویربرداری غده تیروئید استفاده میشود؛ زیرا یون یدید با یونی که حاوی 9943Tc است، اندازه مشابهی دارد. علاوه بر این غده تیروئید هنگام جذب یدید، این بون را نیز جذب میکند. با افزایش مقدار این یون در غده تیروئید، امکان تصویربرداری فراهم میشود.
همه 99Tc موجود در جهان باید بهطور مصنوعی و با استفاده از واکنشهای هستهای ساخته شود. نیمعمر این عنصر کم است و نمیتوان مقادیر زیادی از آن را تهیه و برای مدت طولانی نگهداری کرد. از این رو بسته به نیاز، آن را با یک مولد هستهای تولید و سپس مصرف میکنند.
کاربردهای رادیوایزوتوپ
علیرغم خطر بسیار زیاد رادیوایزوتوپها، با پیشرفت دانش و فناوری، بشر موفق به مهار و بهرهگیری از آنها شده است. این پیشرفت به حدی است که از رادیوایزوتوپها در پزشکی، کشاورژی و سوخت در نیروگاههای اتمی استفاده میشود.
کیمیاگری (تبدیل عنصرهای دیگر به طلا) آرزوی دیرینه بشر بوده است. با پیشرفت علم فیزیک و شیمی، انسان میتواند طلا تولیذ کند. با این حال هزینه تولید آن، به اندازهای زیاد است که صرفه اقتصادی ندارد.
فلزهای پرتوزا
فلزهای پرتوزای گوناگونی کشف و یا ساخته شدهاند. اورانیوم یکی از شناخته شدهترین آنهاست که یکی از ایزوتوپهای آن، اغلب به عنوان سوخت در راکتورهای اتمی به کار میرود. این ایزوتوپ، 235U بوده که فراوانی آن در مخلوط طبیعی از 0.7 درصد کمتر است.
یکی از کاربردهای مواد پرتوزا، استفاده از آنها در تولید انرژی الکتریکی است.
غنیسازی ایزوتوپی
دانشمندان هستهای ایران توانستهاند مقدار ایزوتوپ 235U اورانیوم را در مخلوط ایزوتوپهای این عنصر افزایش دهند. به این فرایند، غنیسازی ایزوتوپی میگویند که یکی از مراحل مهم چرخه تولید سوخت هستهای است. با کسب این موفقیت، نام ایران در فهرست دهگانه کشورهای هستهای جهان ثبت شد. برای تامین بخشی از انرژی الکتریکی مورد نیاز کشور، میتوان این صنعت را گسترش داد و روی آن حساب کرد.
در کنار کاربردها و مزایای این تکنولوژی، پسماند راکتورهای اتمی هنوز خاصیت پرتوزایی دارند و خطرناک هستند. با این حساب، دفع آنها از جمله چالشهای صنایع هستهای به شمار میآید.
با هم بینیدیشیم صفحه 9
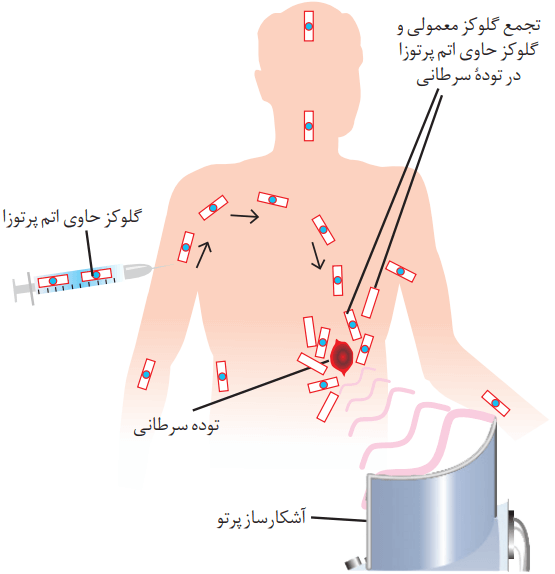
تودههای سرطانی، یاختههایی هستند که رشد غیرعادی و سریعتری دارند. شکل زیر اساس استفاده از رادیوایزوتوپها را برای تشخیص نوعی توده سرطانی نشان میدهد. با بررسی آن، فرایند تشخیص بیماری را توضیح دهید.
نکته: به گلوکز حاوی اتم پرتوزا، گلوکز نشاندار میگویند.
برای تشخیص سلولهای سرطانی، ماده رادیوایزوتوپ (گلوکز حاوی اتم پرتوزا) به بدن فرد تزریق میشود. رادیوایزوتوپها در بافتهایی که متابولیسم بیشتری دارند، بیشتر تجمع دارند. بنابراین از طریق دستگاه گردش خون، این مواد پرتوزا و گلوکزهای معمولی به توده سرطانی که رشد سریعی دارد، وارد میشوند.
درون تودههای سرطانی، رادیوایزوتوپ شروع به پرتودهی میکند و خود بافت، منبع تابش پرتو میشود. در نتیجه پرتوهایی با انرژی مناسب، برای آشکارسازی ساطع میشود. در نهایت دستگاه آشکارساز پرتو میتواند این پرتوها را آشکار کند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 1 شیمی 10، روی لینک های زیر کلیک کنید: