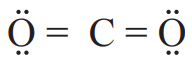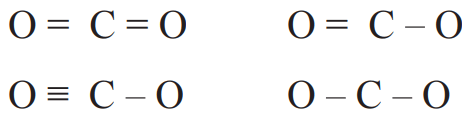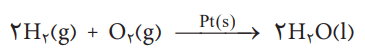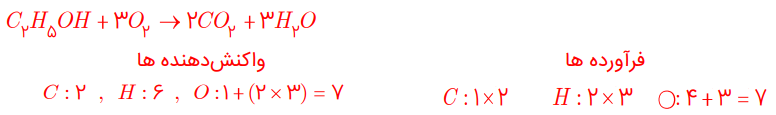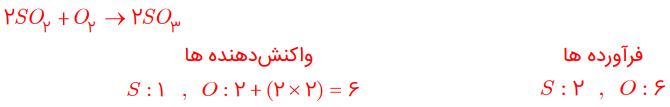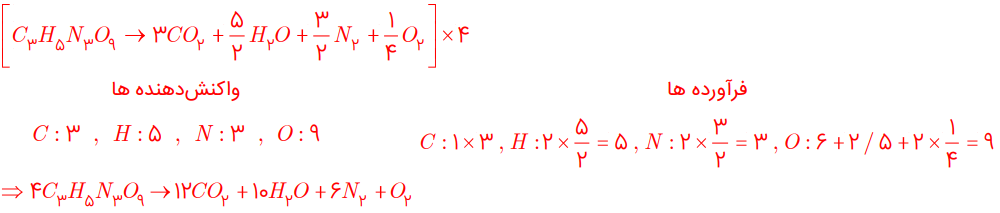آموزش جلسه 2 فصل 2 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
در جلسه قبل علاوه بر اتمسفر زمین، با مفاهیم مختلفی از جمله هوای مایع و نحوه تقطیر آن آشنا شدیم. قرار است در دومین قسمت از فصل دو شیمی ده، به بررسی ترکیب اکسیژن با فلزها و نافلزها بپردازیم.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل دوم شیمی دهم جلسه 2
در این قسمت، بخشی از «آموزش جلسه دوم فصل دوم شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
در ابتدا با اکسیژن که یکی از گازهای واکنشپذیر هواکره است، آشنا میشویم. در مرحله بعد میبینیم که فلزها و نافلزها چگونه با اکسیژن ترکیب میشوند. پس از آن، به بررسی اکسیدها در فراوردههای سوختن و رفتار اکسیدهای فلزی و نافلزی میپردازیم. در ادامه، واکنشهای شیمیایی، قانون پایستگی جرم و موازنه کردن را یاد میگیریم. دو مبحث انتهایی به تاثیر رفتار انسانها بر زمین و اثر گلخانهای اختصاص دارد.
اکسیژن، گازی واکنشپذیر در هواکره؛ جلسه 2 فصل 2 شیمی دهم
اکسیژن یکی از مهمترین گازهای تشکیلدهنده هواکره است. زندگی روی زمین به وجود آن وابسته است. بسیاری از واکنشهای شیمیایی مانند فرسایش سنگ و صخره، زنگزدن، فساد مواد غذایی و …، به دلیل تمایل زیاد اکسیژن برای انجام واکنش است. این عنصر در آب کره، در ساختار مولکولهای آب و در زیست کره، در ساختار همه مولکولهای زیستی وجود دارد. این مولکولهای زیستی شامل کربوهیدراتها، چربیها و پروتئینها میشوند. اکسیژن در هواکره به طور عمده به شکل مولکولهای دو اتمی وجود دارد. مقدار این گاز در لایههای گوناگون هواکره با هم تفاوت دارد.
خود را بیازمایید صفحه 52
در جدول زیر، فشار گاز اکسیژن هوا در ارتفاعهای مختلف از سطح زمین داده شده است:
آ) نمودار فشار گاز اکسیژن را بر حسب ارتفاع، روی کاغذ میلیمتری رسم کنید.
ب) با توجه به نمودار، با افزایش ارتفاع در هواکره فشار گاز اکسیژن چه تغییری میکند؟
فشار کاهش مییابد.
پ) با استفاده از نمودار، فشار این گاز را در ارتفاع 2.5 کیلومتری پیشبینی کنید.
حدود 15 اتمسفر است.
ت) چرا کوهنوردان هنگام صعود به قلههای بلند، از کپسول اکسیژن استفاده میکنند؟
زیرا با افزایش ارتفاع، مقدار گاز اکسیژن در هوا کم میشود.
ث) با استفاده از یک نرمافزار رسم نمودار، این نمودار را رسم کنید.
نمودار فوق با روش نقطه یابی با نرمافزار Excel رسم شده است.
ترکیب اکسیژن با فلزها و نافلزها
اکسیژن در سنگ کره به شکل اکسیدهای گوناگون نیز یافت میشود. مثلا فلز آلومینیم به شکل بوکسیت (Al2O3 به همراه ناخالصی) و سیلیسیم به شکل سیلیس (SiO2) در طبیعت وجود دارد.
شاید تصور کنید که فلزها، تنها یک نوع اکسید در طبیعت دارند. فلزهایی مانند طلا و پلاتین، به حالت آزاد در طبیعت یافت میشوند. افزون بر آنها، فلزهایی وجود دارند که با بیش از یک نوع اکسید در طبیعت شناخته میشوند. نمونهای از این فلزها، آهن است. این فلز در ترکیب با اکسیژن، دو نوع اکسید با فرمولهای شیمیایی FeO و Fe2O3 تولید میکند.
با هم بیندیشیم صفحه 53
در جدول زیر، نام و فرمول شیمیایی برخی اکسیدهای فلزی داده شده است.
1- با بررسی دادههای جدول:
آ) کدام فلزها بیش از یک نوع اکسید تشکیل دادهاند؟
آهن و مس.
ب) نماد کاتیون را در اکسیدهای آهن و مس مشخص کنید.
در Fe2O3 نماد کاتیون، Fe+3 است و در FeO نماد کاتیون، Fe+2 است.
در Cu2O نماد کاتیون، +Cu است و در CuO نماد کاتیون، +Cu2 است.
پ) چه رابطهای بین نام ترکیب با بار الکتریکی این کاتیونها وجود دارد؟
برای نشان دادن بار الکتریکی کاتیون، از عددهای رومی بعد از نام فلز استفاده شده است.
ت) شیوه نام گذاری ترکیبهای یونی را که در آنها کاتیون بارهای الکتریکی متفاوتی دارد، توضیح دهید.
ابتدا نام کاتیون به همراه بار آن در داخل پرانتز نوشته میشود و سپس، نام آنیون نوشته میشود.
2- جدول زیر را کامل کنید.
جدولی که در صفحه 54 شیمی دهم آمده است، بهصورت زیر کامل میشود.
3- اتم عنصر کروم در ترکیبهای خود، اغلب به شکل کاتیون +Cr2 یا +Cr3 یافت میشود. فرمول و نام شیمیایی اکسیدها و کلریدهای آن را بنویسید.
نام گذاری اکسیدهای نافلزی
واکنش عنصرها با اکسیژن، تنها به فلزها محدود نمیشود. نافلزها هم با اکسیژن واکنش میدهند و به اکسید نافلزها تبدیل میشوند. در واقع اکسیدهای نافلزی، دسته دیگری از ترکیبهای شیمیایی هستند که از واکنش نافلزها با اکسیژن تولید میشوند. ترکیبهایی مانند CO2، SO2، SO3 و NO2، نمونههایی از اکسیدهای نافلزی هستند.
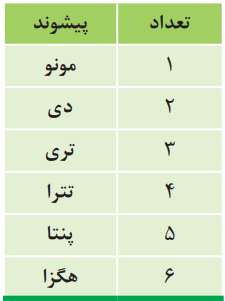
هر زیروند در فرمول شیمیایی، نمایانگر شمار اتمهای آن عنصر در ترکیب است. از این رو شیمیدانها برای بیان شمار هر یک از اتمها، پیشوندهای معرفی شده در جدول زیر را به کار میبرند.
برای نمونه، به فرمول و نام شیمیایی ترکیب زیر توجه کنید:
N2O4
دی نیتروژن تترا اکسید
نام شیمیایی این ماده، الگویی برای نام گذاری این نوع ترکیبها است.
در ابتدا، شمار و نام عنصری گفته میشود که در سمت چپ فرمول شیمیایی نوشته شده است. سپس، شمار و نام عنصر دوم با پسوند «ید» بیان میشود.
خود را بیازمایید صفحه 55
نام ترکیبها در ستون نخست و فرمول شیمیایی ترکیبها در ستون دوم را بنویسید.
آ) NO2
نیتروژن دی اکسید
ب) CO
کربن مونوکسید
پ) SO2
گوگرد دی اکسید
ت) PCl3
فسفر تری کلرید
ث) SiBr4
سیلسیم تترا برمید
ج) دی نیتروژن تری اکسید
N2O3
چ) کربن دی سولفید
CS2
ح) گوگرد تری اکسید
SO3
خ) کربن تترا کلرید
CCl4
د) نیتروژن تری فلوئورید
NF3
با هم بیندیشیم صفحه 55
الکترونهای لایه ظرفیت در اتمها هنگام چینش، از آرایش الکترون-نقطهای (ساختار لوویس) پیروی میکنند. طبق این مدل همه اتمهای سازنده ترکیب، بنا بر قاعده هشتتایی رفتار میکنند. با توجه به آرایش الکترون-نقطهای کربن دی اکسید، روشی برای رسم ساختار لوویس مولکولها بیابید.
1- شمار کل الکترونهای لایه ظرفیت اتمهای سازنده را حساب کنید. برای این کار، شمار الکترونهای لایه ظرفیت اتمهای سازنده را با هم جمع کنید.
کل الکترونهای ظرفیت را بهصورت زیر میشود محاسبه کرد.
1 (4) + 2 (6) = 16
2- ساختارهای ممکن که در آنها، اتمهای کربن و اکسیژن با یک، دو یا سه پیوند اشتراکی به هم متصل شدهاند بهصورت زیر است:
3- الکترونهای ناپیوندی روی اتمها را با جفت نقطه نشان دهید. باید پیرامون هر اتم در مجموع، هشت الکترون (پیوندی + ناپیوندی) وجود داشته باشد.
4- از میان ساختارهایی که رسم کردهاید، آنکه ویژگیهای زیر را دارد، ساختار لوویس درست ترکیب را نشان میدهد:
- مجموع الکترونهای پیوندی و ناپیوندی در مولکول، برابر با مجموع الکترونهای لایه ظرفیت اتمهای سازنده آن باشد.
- همه اتمها به آرایش هشتتایی رسیده باشند. اتم هیدروژن همواره یک پیوند تشکیل میدهد، از این رو تنها با دو الکترون پایدار میشود.
راهنمایی: در رسم ساختار لوویس، هنگامی که اتمهای یکسانی به اتم مرکزی متصلاند، نمایش پیوند دوگانه بر پیوند سهگانه مقدم است.
اکنون با روشی که آموختهاید، ساختار لوویس هر یک از مولکولهای زیر را رسم کنید.
آ) SO2
ب) CO
پ) PCl3
ت) HCN
ث) CH2O
ج) CS2
اکسیدها در فراوردههای سوختن
اکسیژن، گازی واکنشپذیر است و با اغلب عنصرها و مواد واکنش میدهد. شیمیدانها از این ویژگی برای تهیه بسیاری از مواد بهره میگیرند. در صنعت برای تهیه سولفوریک اسید، نخست گوگرد را در واکنش با اکسیژن به SO2 تبدیل میکنند. این واکنش به سوختن گوگرد معروف است. برخی عنصرهای فلزی و نافلزی نیز میتوانند با اکسیژن بسوزند و به اکسیدهای فلزی و نافلزی تبدیل شوند.
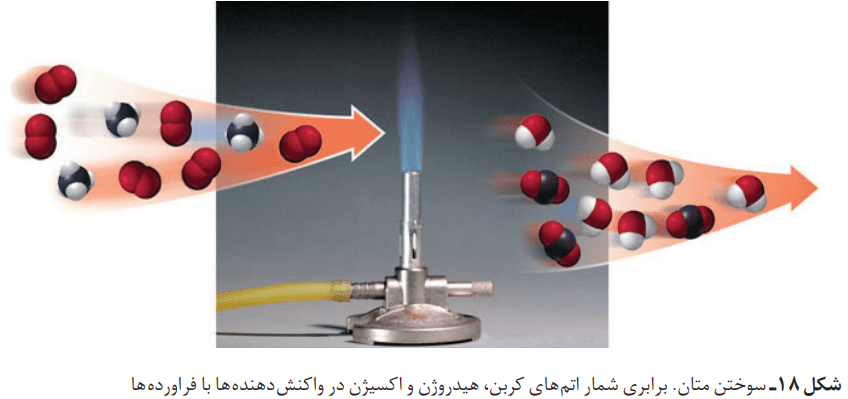
در شکل پایین، نمونههایی از این واکنشها را میتوانید مشاهده میکنید.
سوختن، واکنشی شیمیایی است که در آن، یک ماده با اکسیژن به سرعت واکنش میدهد. بخشی از انرژی شیمیایی این واکنش، بهصورت گرما و نور آزاد میشود. افزون بر برخی عنصرها، دیگر مواد از جمله سوختهای فسیلی نیز در شرایط مناسب میسوزند.
برای نمونه، زغال سنگ در حضور اکسیژن میسوزد و افزون بر تولید گازهای SO2، CO2 و بخار آب، مقدار زیادی انرژی آزاد میکند.
نور و گرما + کربن دی اکسید + گوگرد دی اکسید + بخار آب → اکسیژن + زغال سنگ
سوختن کامل و ناقص
نوع فراوردهها در واکنش سوختن سوختهای فسیلی، به مقدار اکسیژن در دسترس بستگی دارد. اگر اکسیژن کافی باشد، سوختن کامل انجام میشود و گاز کربن دی اکسید و بخار آب تولید میگردد.
اگر مقدار اکسیژن کم باشد، گاز کربن مونوکسید به همراه دیگر فراوردهها تولید خواهد شد. در این حالت گفته میشود که سوختن ناقص است.
کربن مونوکسید
کربن مونوکسید، گازی بیرنگ، بیبو و بسیار سمی است. چگالی این گاز کمتر از هوا و قابلیت انتشار آن در محیط بسیار زیاد است؛ به طوری که به سرعت در همه اتاق پخش میشود.
میل ترکیبی هموگلوبین خون با این گاز بسیار زیاد و بیش از 200 برابر اکسیژن است. مولکولهای کربن مونوکسید پس از اتصال به هموگلوبین، از رسیدن اکسیژن به بافتهای بدن جلوگیری میکنند. این ویژگی باعث مسمومیت میشود و سامانه عصبی را فلج میکند. این میل ترکیبی میتواند قدرت هرگونه اقدامی را از فرد مسموم بگیرد و باعث مرگ او شود.
در میان تارنماها صفحه 58
این مطلب دارای دو سوال است که در ادامه به بررسی آنها میپردازیم.
سوال 1
بیشتر مرگ و میرهای ناشی از گاز گرفتگی، به دلیل عدم رعایت اصول ایمنی هنگام استفاده از وسایل گرمایشی است. روشهای استاندارد انتقال گازهای حاصل از سوختن سوختها به بیرون از خانه چیست؟ چه روشهایی برای جلوگیری از گاز گرفتگی وجود دارد؟
- هنگام نصب هرگونه وسیله گرمازا، ابتدا از صحت و درست نصب شدن آن باید اطمینان حاصل شود. این بررسی باید طبق دستورالعمل کارخانه سازنده وسیله باشد.
- از سوزاندن زغال چوب در داخل خانه، گاراژ، چادر و کانکس خودداری کنید.
- برای گرم کردن خانه از بخاری و چراغ خوراکپزی نفتی، گاز پیکنیک و … استفاده نکنید. در صورت استفاده مطمئن شوید که هوای آزاد، از خارج به داخل خانه جریان دارد.
- هنگام استفاده از وسایل گرمازای سوختنی، مطمئن شوید که از دودکش مناسب برای آن استفاده میکنید.
- از تغییر خودسرانه وسایل گرمازای سوختنی بپرهیزید.
- هرگز از وسایل گرمازای سوختنی بدون دودکش، در اتاق دربسته یا بدون پنجره استفاده نکنید.
- از به کارگیری وسایل گرمازای گازوئیلی در داخل خانه بپرهیزید.
- همواره مراقب تهویه کافی جریان هوا در داخل خانه باشید.
- بازدید سالانه وسایل گرمازای سوختنی قبل از فصل سرما توسط افراد حرفهای ضروری است.
سوال 2
امروزه در برخی خانهها از دستگاهی برای اعلام نشت کربن مونوکسید استفاده میکنند. با مراجعه به منابع علمی معتبر درباره شیوه کار این دستگاه گزارش تهیه کنید.
حسگرهای گاز کربن مونوکسید را با توجه به تکنولوژی به کار رفته در آنها، میتوان به سه گروه اصلی طبقه بندی کرد:
- حسگر بایومیمتیک
- حسگر نیمه هادی اکسید فلزی
- حسگر الکتروشیمیایی
الف) حسگر بایومیمتیک:
این حسگر یک صفحه از الیاف مصنوعی و شفاف و حساس به گاز CO دارد. صفحه آن به صورت عمود بر مسیر پرتویی از نور مادون قرمز قرار گرفته است. با برخورد گاز CO به صفحه حساس، این صفحه به تدریج تیره و کدر میشود. همزمان با کدر شدن صفحه، پرتوی عبوری هم کاهش مییابد.
ب) حسگر نیمه هادی اکسید فلزی:
این حسگر بر پایه تاثیر گاز CO بر مقاومت الکتریکی یک قطعه نیمه هادی پایه اکسید فلزی ساخته میشود. با استفاده از یک گرم کننده الکتریکی، صفحه نازک نیمه هادی تا حدود 400 درجه سانتیگراد گرم میشود. در این حالت اکسیژن هوا، موجب افزایش مقاومت الکتریکی نیمه هادی میشود. حضور گاز CO مقاومت الکتریکی آن را کاهش میدهد که مبنای سنجش غلظت گاز CO در هوا است.
ج) حسگر الکتروشیمیایی:
حسگر الکتروشیمیایی از فناوری پیل سوختی ایده گرفته است. در این حسگر دو الکترود از جنس پلاتین در طرفین یک محیط الکترولیت که وظیفه انتقال یونها را بر عهده دارد، قرار گرفتهاند. الکترولیت معمولا از جنس سولفوریک اسید است. گاز CO در مجاورت یکی از الکترودها با بخار آب موجود در هوا واکنش میدهد. نتیجه تبدیل CO به CO2 و ورود یونهای مثبت هیدروژن به داخل الکترولیت است. یونهای مثبت با اکسیژن هوا واکنش داده و مجددا تبدیل به بخار آب میشود.
دقت شناسایی غلظت گاز COدر حسگر الکتروشیمیایی، به مراتب بیشتر از انواع دیگر حسگرها است.
خود را بیازمایید صفحه 58
یکی از کاربردهای آرگون، ایجاد محیط بی اثر هنگام جوشکاری است. به نظر شما این روش، بر استحکام و طول عمر فلز جوشکاری شده چه تاثیری خواهد داشت؟
این گاز از ترکیب فلز مذاب با اکسیژن هوا در هنگام جوشکاری جلوگیری میکند. در نتیجه استحکام قسمت جوش خورده بیشتر و طول عمر فلز جوشکاری شده بیشتر میشود.
رفتار اکسیدهای فلزی و نافلزی
اکسیدهای فلزی و نافلزی به دلیل تنوع رفتار، کاربردهای فراوانی در زندگی دارند. برخی کشاورزان کلسیماکسید (آهک) را به عنوان اکسید فلزی برای افزایش بهرهوری در کشاورزی به خاک میافزایند. افزودن این نوع مواد به خاک، سبب میشود تا مقدار و نوع مواد معدنی در دسترس گیاه تغییر کند. همچنین از کلسیماکسید میتوان برای کنترل میزان اسیدی بودن آب دریاچهها استفاده کرد.
مرجانها، گروهی از کیسهتنان با اسکلت آهنی هستند. پژوهشها نشان میدهند که این جانداران با افزایش مقدار کربن دی اکسید محلول در آب از بین میروند. این امر به دلیل افزایش خاصیت اسیدی آب است.
به طور کلی، اکسیدهای فلزی را اکسیدهای بازی و اکسیدهای نافلزی را اکسیدهای اسیدی مینامند. دلیل آن این است که از واکنش اغلب آنها با آب، به ترتیب باز و اسید تولید میشود.
پیوند با زندگی
زندگی و ادامه آن روی زمین، به بارشهای آسمانی وابسته است. باران از جمله این نعمتها است که علاوه بر ایجاد پاکی و نشاط، به طبیعت جان دوباره میبخشد.
آلودگیهای ناشی از صنایع و فناوریهای ساخته بشر، گاهی همین باران را هم مشکلساز میکنند. باران به دلیل CO2 حلشده در آن، اندکی اسیدی است و pH کمتر از 7 دارد.
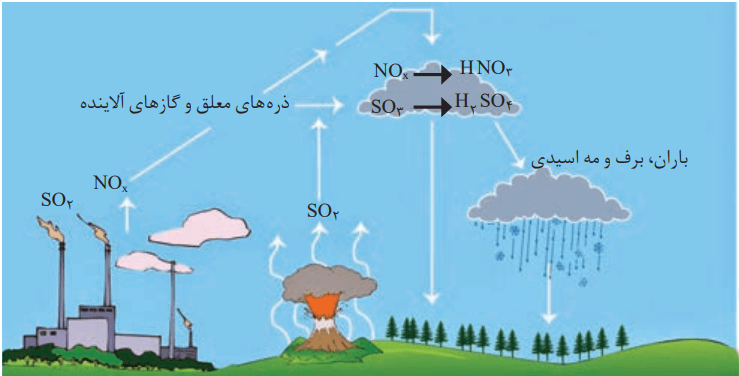
اکسیدهای اسیدی باران
در شیمی هواکره، اصطلاح رایجی با عنوان «آنچه به بالا میرود، سرانجام باید پایین بیاید» وجود دارد. آلایندههایی که از سوختن سوختهای فسیلی وارد هواکره میشوند و بالا میروند، سرانجام باید به زمین برگردند. این آلایندهها به طور عمده شامل اکسیدهای اسیدی NO2 و SO2 هستند که هنگام بارش در آب حل میشوند. بارشی که خاصیت اسیدی چشمگیری دارد و به زمین فرو میریزد. در این حالت میگوییم که باران اسیدی باریده است.
روند تولید باران اسیدی را در شکل زیر میتوانید مشاهده کنید.
باران اسیدی آثار جبران ناپذیری بر جنگلها، باغهای میوه و زندگی آبزیان دارد. دلیل آن این است که تغییر میزان خاصیت اسیدی آب، به بافتهای جانداران آسیب میزند.
آثار زیانبار باران اسیدی بر روی پوست، دستگاه تنفس و چشمها به سرعت قابل تشخیص است. گاهی خاصیت اسیدی باران، باعث خشکی و ترکخوردگی پوست بدن میشود.
واکنشهای شیمیایی و قانون پایستگی جرم
در هر تغییر شیمیایی مانند سوختن مواد، فساد مواد غذایی و … از یک یا چند ماده شیمیایی، ماده (مواد) تازهای تولید میشود. هر تغییر شیمیایی میتواند شامل یک یا چند واکنش شیمیایی باشد که هر یک از آنها را با یک معادله نشان میدهند. در این معادله، واکنشدهندهها در سمت چپ و فراوردهها در سمت راست نوشته میشوند.
سوختن کربن را میتوان به صورت زیر نمایش داد:
کربن دی اکسید → اکسیژن + کربن
C(s) + O2(g) → CO2(g)
معادله نخست، نوشتاری و معادله دوم، نمادی نام دارد. معادله نمادی، فرمول شیمیایی واکنشدهندهها و فراوردهها را نمایش میدهد. علاوه بر این، حالت فیزیکی آنها و اطلاعاتی درباره شرایط واکنش نیز ارائه میکند.
معادله شیمیایی زیر بیان میکند که این واکنش، در حضور کاتالیزگر پلاتین انجام میشود.
یکی از ویژگیهای مهم واکنشهای شیمیایی، پیروی همه آنها از قانون پایستگی جرم است.
نمادهای نمایش حالت فیزیکی مواد
حالت فیزیکی مواد در معادلههای شیمیایی را میتوان با استفاده از نمادهای جدول زیر نمایش داد.
در معادله واکنش، رسوب حالت جامد، مذاب حالت مایع و بخار حالت گاز دارد.
با هم بیندیشیم صفحه 61
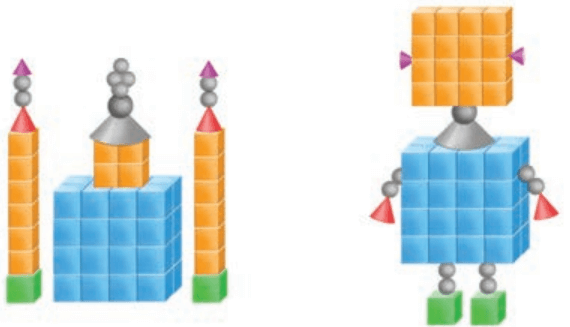
1- دو دانشآموز با استفاده از قطعههای پلاستیکی، دو دستسازه به شکلهای زیر درست کردهاند. درباره جرم این دو دستسازه گفتگو کنید و شرط برابری جرم آنها را بنویسید.
چون نوع و تعداد ذرات به کار رفته در هر دو دستسازه یکسان است، بنابراین دارای جرمهای یکسانی هستند.
2- جای خالی را پر کنید.
جرم نقره – جرم نقره سولفید = جرم گوگرد
32g = 215.8 – 247.8 = جرم گوگرد
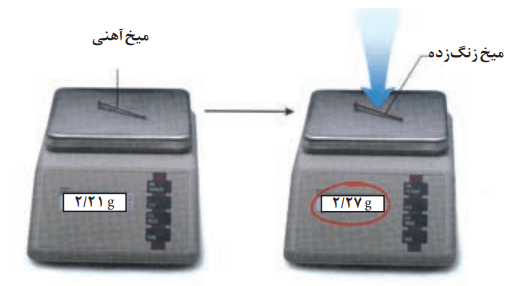
3- میخ آهنی در هوای مرطوب زنگ میزند. با توجه به جرمی که ترازوها نشان میدهند، قانون پایستگی جرم را در این واکنش توضیح دهید.
میخ آهنی با اکسیژن هوا و آب ترکیب شده و تبدیل به آهن اکسید شده است. بنابراین با جذب مقداری اکسیژن و رطوبت، مقداری افزایش جرم پیدا کرده است.
4- درباره درستی جمله زیر در کلاس گفتگو کنید.
«جرم کل مواد موجود در مخلوط واکنش ثابت است.»
طبق قانون پایستگی جرم، در واکنشهای شیمیایی، واکنشدهندهها به فراوردهها تبدیل میشوند. در عین حال، اتمها به وجود نمیآیند یا از بین نمیروند؛ بلکه از آرایشی به آرایش دیگر در میآیند. بنابراین در هر لحظه از واکنش، جرم کل مواد موجود در واکنش ثابت باقی خواهد ماند.
موازنه کردن معادله واکنشهای شیمیایی
در واکنشهای شیمیایی، اتمی از بین نمیرود و به وجود هم نمیآید. پس از انجام واکنش، اتمهای واکنشدهندهها به شیوههای دیگری به هم متصل میشوند و فراوردهها را به وجود میآورند. این ویژگی نشان میدهد که جرم مواد، پیش از واکنش برابر با جرم مواد، پس از واکنش است. به عبارت دیگر، جرم مواد شرکت کننده در یک واکنش شیمیایی، ثابت است.
مطابق قانون پایستگی جرم، شمار اتمهای هر عنصر در یک واکنش شیمیایی ثابت است.
برای این واکنش میتوان معادله نمادی به صورت زیر نوشت:
CH4(g) + O2(g) → CO2(g) + H2O(g)
در این معادله، شمار اتمهای کربن در واکنشدهندهها (متان) برابر با 1 و در فراوردهها (کربن دی اکسید) نیز با 1 برابر است. با این حال شمار اتمهای هیدروژن و اکسیژن در دو سوی معادله، برابر نیست. برای اینکه شمار اتمهای این دو عنصر نیز در دو سوی معادله برابر شود، میتوان یک کاری انجام داد. باید به O2 و H2O ضریب 2 داده شود؛ در این صورت، معادله موازنه شده به دست میآید.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
با توجه به معادله بالا، میتوان برای موازنه کردن هر معادله نمادی یک نتیجهگیری انجام داد. باید برای هر یک از واکنشدهندهها و فراوردهها ضریبی قرار داد تا شمار اتمهای هر عنصر، در دو سوی معادله برابر شود.
موازنه به روش وارسی
یکی از سادهترین روشهای موازنه، روش وارسی است. در این روش اغلب به ترکیبی که دارای بیشترین شمار اتم است، ضریب 1 میدهند. سپس با توجه به شمار اتمهای این ترکیب، ضرایبی را به دیگر مواد میدهند. سرانجام شمار اتمهای هر عنصر در دو سوی معادله برابر میشود.
معادله نمادی سوختن کامل پروپان، به صورت زیر است. توجه داشته باشید که این معادله به شکل موازنه نشده است.
C3H8(g) + O2(g) → CO2(g) + H2O(g)
برای موازنه، به C3H8 ضریب 1 بدهید.
1C3H8(g) + O2(g) → CO2(g) + H2O(g)
اینک شمار اتمهای کربن و هیدروژن در سمت چپ مشخص شده است. حال اگر به H2O ضریب 4 و به CO2 ضریب 3 بدهید، شمار اتمهای C و H در دو طرف برابر میشود.
1C3H8(g) + O2(g) → 3CO2(g) + 4H2O(g)
شمار اتمهای اکسیژن در سمت راست، تعیین شده و برابر با 10 اتم است. اگر به اکسیژن در سمت چپ، ضریب 5 بدهید، شمار اتمهای همه عنصرها در دو سوی معادله برابر میشوند.
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g)
عدم تغییر زیروند و نحوه انتخاب ضریب
هنگام موازنه کردن نباید زیروندها را در فرمول شیمیایی واکنشدهندهها و فراوردهها تغییر داد. توجه کنید که هر یک از ضریبها در معادله موازنه شده، باید کوچکترین عدد طبیعی ممکن باشد.
به روش موازنه معادله واکنش سوختن گاز هیدروژن دقت کنید. این معادله موازنه نشده است.
H2(g) + O2(g) → H2O(g)
در اینجا برای موازنه به H2O، ضریب 1 میدهیم.
H2(g) + O2(g) → 1H2O(g)
حال شمار اتمهای H و O در سمت راست معادله مشخص شده است. اگر به H2 ضریب 1 و به O2 ضریب ½ بدهیم، شمار اتمهای هر دو عنصر در دو سوی معادله برابر میشود.
1H2(g) + ½O2(g) → 1H2O(g)
در پایان برای از بین بردن ضریب کسری اکسیژن، همه ضریبها را در عدد 2 ضرب میکنیم. به این ترتیب معادله موازنه شده به دست میآید.
2H2(g) + O2(g) → 2H2O(g)
خود را بیازمایید صفحه 64
معادله واکنشهای زیر را موازنه کنید:
آ) C2H5OH + O2 → CO2 + H2O
ب) SO2 + O2 → SO3
پ) C3H5N3O9 → CO2 + H2O + N2 + O2
چه بر سر هواکره میآوریم؟
در سده گذشته با تحول صنعتی، ماشینآلات سنگین طراحی و ساخته شد. این تحول، صنایع بزرگ را به وجود آورد. فراوردههای کشاورزی، دارویی، غذایی، نساجی، پتروشیمیایی و … به صورت انبوه و در مقیاس صنعتی تولید شدند. برای چرخاندن چرخهای صنایع جدید، نیاز به انرژی الکتریکی بیش از پیش احساس شد.
این فعالیتها سبب شد تا میزان مصرف بیحساب سوختهای فسیلی افزایش یابد. در نتیجه این اوامر، حجم انبوهی از کربن دی اکسید، وارد هواکره میشود.
کربن دی اکسیدی که وارد هواکره شده، در آن جابجا میشود. این گاز میتواند هوای شهرهای دیگر را نیز آلوده کند. با این حساب، هر رفتار ما بر زندگی همه مردمان جهان اثر خواهد گذاشت.
هوای آلوده بوی بدی دارد و چهره شهر را زشت میکند. این هوا باعث سوزش چشم، سردرد، تهوع و به وجود آمدن انواع بیماریهای تنفسی مانند سرطان ریه میشود.
تاثیر سبک زندگی بر زمین و هواکره
انسانها با رفتارها و سبک زندگی و وسایلی که استفاده میکنند، روی هواکره تاثیر میگذارند.
درباره این موضوع، میتوان به موارد زیر اشاره کرد:
- نوع وسیله نقلیهای که برای رفتن به مدرسه، محل کار، سفر و … استفاده میکنیم.
- غذایی که میخوریم.
- نوع وسایل گرمایشی
- مدت زمانی که موهای خود را با سشوار خشک میکنیم.
- در این مدت به دلیل مصرف انرژی الکتریکی، مقداری کربن دی اکسید وارد هواکره میشود و درصد گازهای آن را تغییر میدهد.
سبک زندگی میتواند بیانگر میزان اثرگذاری هر یک از انسانها بر کره زمین و هواکره باشد. ردپا اصطلاحی است که به این اثر نسبت دادهاند. یکی از این ردپاها، ردپای کربن دی اکسید است. مقدار کربن دی اکسید در هواکره از مقدار طبیعی آن نباید بالاتر برود. این مقدار اضافی باید به وسیله گیاهان یا دیگر پدیدههای طبیعی مصرف شود. اگر کربن دی اکسید وارد شده به طبیعت زیادتر باشد، ردپای ایجاد شده سنگینتر و اثر آن ماندگارتر است. دلیلش این است که زمان لازم برای تعدیل این اثر به وسیله پدیدههای طبیعی طولانیتر است.
رصد دمای کره زمین
دانشمندان از طریق روشهای متفاوت، پیوسته دمای کره زمین را در سرتاسر نقاط آن رصد میکنند.
از روشهای رصد دمای کره زمین، استفاده از این موارد را میشود نام برد:
- بالونهای هواشناسی
- ماهوارهها
- کشتیهای اقیانوسپیما
- گویچههای شناور در دریاها که به حسگرهای دما مجهز هستند.
طبق شواهد در طول قرن گذشته، میانگین دمای کره زمین افزایش یافته است. این افزایش دما سبب شده تا شرایط آب و هوایی در نقاط گوناگون زمین تغییر کند. به نظر شما چه عواملی سبب ایجاد این تغییرات میشوند؟
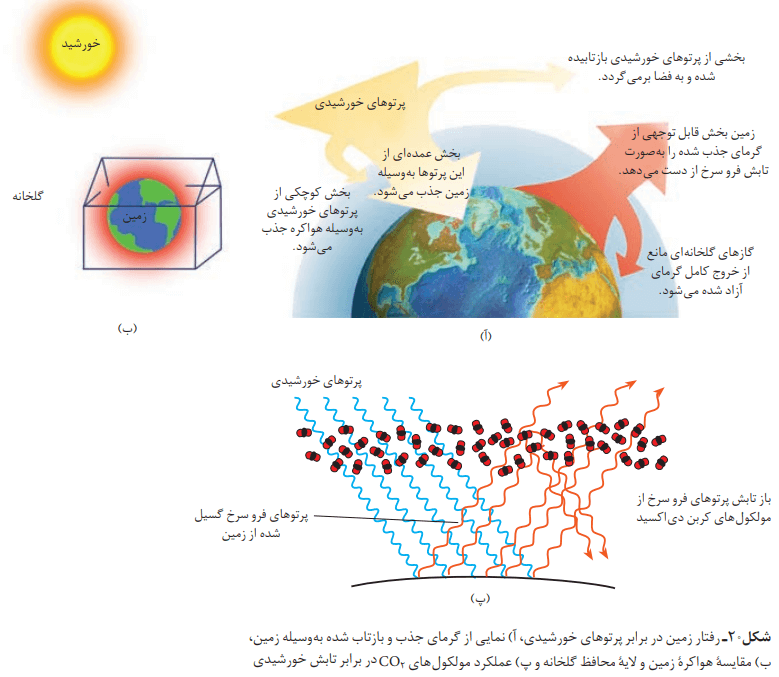
اثر گلخانهای
گلخانهها زمینهای کشاورزی ویژهای هستند که دور تا دور آنها را تا ارتفاع معینی با لایهای از پلاستیکهای شفاف میپوشانند. در آنها گیاهان و میوههای گوناگونی را پرورش میدهند.
در گلخانهها در چهار فصل سال بهویژه زمستان، فراوردههای کشاورزی گوناگونی کشت میشود. از این فراوردهها میتوان به موارد زیر اشاره کرد:
- قارچ
- خیار
- گوجه فرنگی
- توتفرنگی
نور خورشید هنگام گذر از هواکره با مولکولها و دیگر ذرههای آن برخورد میکند و تنها بخشی از آن به سطح زمین میرسد. از اینرو، زمین گرم میشود و مانند یک جسم داغ از خود پرتوهای الکترومغناطیس گسیل میدارد. انرژی پرتوهای گسیل شده، کمتر و طول موج آنها بلندتر است. حال میشود درک کرد که چگونه لایه پلاستیکی، سبب گرم شدن گلخانه میشود.
میدانیم که کره زمین با لایهای از گازها به نام هواکره احاطه شده است. این لایه برای زمین همانند لایه پلاستیکی برای گلخانه است و سبب گرم شدن کره زمین میشود. اگر این لایه وجود نداشت، میانگین دمای کره زمین به منفی 18 درجه سانتیگراد کاهش مییافت.
پرتوهای خورشیدی پس از برخورد به زمین، باید دوباره با طول موجهای بلندتر به هواکره برگردند. برخی گازهای موجود در هواکره مانند CO2، H2O و … مانع از خروج آنها میشوند و بدین ترتیب، زمین را گرمتر میکنند. هر چه مقدار این گازها در هواکره بیشتر باشد، دمای زمین بالاتر خواهد رفت.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 2 شیمی 10، روی لینک های زیر کلیک کنید: