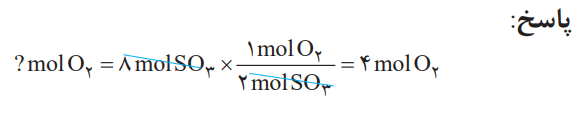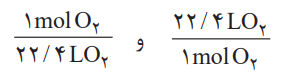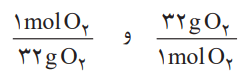آموزش جلسه 4 فصل 2 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
در جلسه سوم با شیمی سبز، اوزون و رفتار گازها آشنا شدیم. قرار است در جلسه چهارم به نسبت مولی در واکنشهای گازی بپردازیم.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل دوم شیمی دهم جلسه 4
در این قسمت، بخشی از «آموزش جلسه چهارم فصل دوم شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
در ابتدا به بررسی این میپردازیم که در هر واکنش، چه مقدار از هر گازی لازم است. پس از آن، با استوکیومتری واکنش آشنا میشویم. مطلب آخر هم به نحوه تولید آمونیاک و روش هابر اختصاص دارد.
از هر گاز چقدر؛ جلسه 4 فصل 2 شیمی دهم
واکنش گازها در صنعت، اهمیت و کاربردهای بسیاری دارد. در ادامه دو مورد از فرایندهای تهیه را در سایت رپیتیچ با همدیگر بررسی میکنیم.
هر یک از فرایندهای تهیه سولفوریک اسید و نیتریک اسید، شامل چندین واکنش گازی متوالی است. یکی از این واکنشها، تبدیل گاز گوگرد دی اکسید به گوگرد تری اکسید است.
2SO2(g) + O2(g) → 2SO3(g)
شرح معادله موازنه شده واکنش بالا به این صورت است. دو مول گاز گوگرد دی اکسید با یک مول گاز اکسیژن واکنش میدهد و دو مول گاز گوگرد تری اکسید تولید میشود. میتوان گفت نسبت مولی اکسیژن مصرف شده به گوگرد تری اکسید تولید شده، 1 به 2 است. به عبارت دیگر، نسبتهای کمی زیر برقرار است:
به هر یک از این نسبتها، یک عامل (کسر) تبدیل میگویند. با استفاده از آنها میتوان شمار مولهای هر ماده شرکت کننده در واکنش را از شمار مولهای دیگری به دست آورد.
نمونه حل شده
برای تولید 8 مول گاز گوگرد تری اکسید، به چند مول گاز اکسیژن نیاز است؟
برای این منظور، به 4 مول گاز اکسیژن نیاز داریم.
استوکیومتری واکنش
در بخشی از شیمی، به ارتباط کمی میان مواد شرکت کننده (واکنش دهندهها و فراوردهها) در هر واکنش میپردازند. به این بخش از شیمی، استوکیومتری واکنش میگویند. شیمیدانها با بهرهگیری از آن، مشخص میکنند که برای تولید مقدار معینی از یک فراورده، به چه مقدار از هر واکنش دهنده نیاز است.
به واکنش آرام مواد با اکسیژن که با تولید انرژی همراه است، واکنش اکسایش میگویند.
با هم بیندیشیم صفحه 81
معادله واکنش اکسایش گلوکز، برای تولید انرژی در بدن به صورت زیر است:
C6H12O6(aq) + 6O2(g) → 6CO2(g) + 6H2O(l) + انرژی
آ) بدن انسان در هر شبانهروز به طور میانگین، 2.5 مول گلوکز مصرف میکند. برای مصرف این مقدار گلوکز، به چند مول اکسیژن نیاز است؟
همانطور که در معادله واکنش گلوکز دیدیم، ضریب خود گلوکز برابر با 1 است. از طرف دیگر، به ازای هر مول گلوکز، نیاز به 6 مول اکسیژن برای اکسایش داریم. با این حساب برای مصرف 2.5 مول گلوکز، به 15 مول اکسیژن نیاز داریم.
ب) این مقدار اکسیژن، هم ارز با چند لیتر گاز اکسیژن در STP است؟
راهنمایی: برای حل میتوان یکی از عاملهای تبدیل زیر را به کار برد:
پ) این مقدار اکسیژن، هم ارز با چند گرم اکسیژن است؟
راهنمایی: برای حل میتوان یکی از عاملهای تبدیل زیر را به کار برد:
تولید آمونیاک، کاربردی از واکنش گازها در صنعت
گاز نیتروژن فراوانترین جزءِ سازنده هواکره است. این گاز در مقایشه با اکسیژن، از نطر شیمیایی غیرفعال و واکنشناپذیر است. مخلوطی از گارهای اکسیژن و هیدروژن را در حضور کاتالیزگر یا جرقه در نظر بگیرید. این مخلوط در یک واکنش سریع و شدید، منفجر میشود و آب تولید میکند. با این حال در مخلوطی از گازهای نیتروژن و هیدروژن حتی در حضور کاتالیزگر یا جرقه، هیچ واکنشی رخ نمیدهد.
مخلوط هیدروژن و اکسیژن را در حضور کاتالیزگر یا جرقه میبینید که به تولید آب میانجامد:
2H2(g) + O2(g) → 2H2O(l)
در پایین مخلوط هیدروژن و نیتروژن را میبینید که حتی در حضور کاتالیزگر یا جرقه، واکنشی رخ نمیدهد.
H2(g) + N2(g) → واکنشی رخ نمیدهد
از اینرو گاز نیتروژن، به جوّ بیاثر شهرت یافته است. در محیطهایی که گاز اکسیژن عامل ایجاد تغییر شیمیایی است، به جای آن از گاز نیتروژن استفاده میکنند.
روش هابر در تولید آمونیاک
فهمیدیم که گاز نیتروژن، واکنش پذیری ناچیزی دارد. با این حال در صنعت از آن مواد گوناگونی تهیه میکنند که آمونیاک، یکی از مهمترین آنهاست. اگر واکنش پذیری نیتروژن ناچیز است، چگونه از آن میتوان آمونیاک و ترکیبهای دیگر را تهیه کرد؟
یافتن پاسخ این پرسش به حدی اهمیت داشت که فریتس هابر در سال 1918، به خاطر آن برنده جایزه نوبل شیمی شد. او توانست با استفاده از گازهای H2 و N2، آمونیاک را تهیه کند.
هابر واکنش زیر را مبنای پژوهشهای خود قرار داد. توجه کنید که واکنش در شرایط بهینه در نظر گرفته شده است.
3H2(g) + N2(g) → 2NH3(g)
بزرگترین چالش هابر، یافتن شرایط بهینه برای انجام این واکنش بود، به طوری که:
واکنش در دما و فشار اتاق انجام نمیشد.
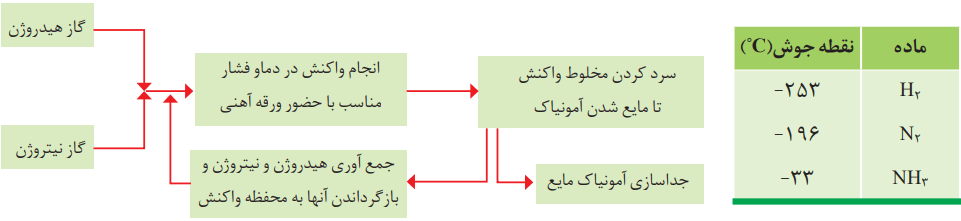
هابر واکنش میان گازهای هیدروژن و نیتروژن را بارها در دماها و فشارهای گوناگون انجام داد تا بتواند شرایط بهینه آن را پیدا کند. سرانجام دریافت که باید مخلوط را از روی یک ورقه آهنی (کاتالیزگر) در دما و فشار مناسب عبور دهد. هنگام انجام واکنش در حضور ورقه آهنی، مقدار قابل توجهی آمونیاک تولید میشود. با این حال همه واکنش دهندهها به فراورده تبدیل نخواهند شد. دلیل آن، برگشتپذیر بودن واکنش است. با این حساب در ظرف واکنش مخلوطی از سه گاز هیدروژن، نیتروژن و آمونیاک وجود دارد.
اکنون هابر با مشکل دیگری روبرو بود:
- چگونه میتوان فراورده واکنش (آمونیاک) را از مخلوط واکنش جدا کرد.
او با بررسی نقطه جوش این مواد، راه حلی را برای جداسازی آمونیاک پیدا کرد. طرح زیر، راهحل هابر را نشان میدهد.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 2 شیمی 10، روی لینک های زیر کلیک کنید: