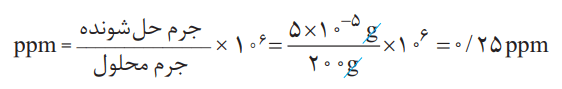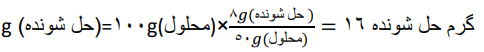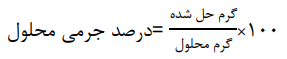آموزش جلسه 2 فصل 3 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
در جلسه قبل یاد گرفتیم که غلظت محلولها را با روشهای گوناگونی نشان میدهند. یکی از این روشها، قسمت در میلیون است که قرار است در جلسه دوم به آن بپردازیم.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل سوم شیمی دهم جلسه 2
در این قسمت، بخشی از «آموزش جلسه دوم فصل سوم شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
در ابتدا با قسمت در میلیون یا همان ppm آشنا میشویم و پس از آن یک نمونه حل شده از آن را مشاهده میکنیم. مبحث بعدی به تبلور اختصاص دارد که بهوسیله آن، منابع مختلفی را میشود تهیه کرد.
قسمت در میلیون (ppm)؛ جلسه 2 فصل 3 شیمی دهم
هرگاه نیم گرم مس (II) سولفات را در 99.5 گرم آب حل کنیم، محلولی زیبا به رنگ آبی بهدست میآید. میتوان این محلول را با افزودن آب، چندین مرتبه رقیقتر کرد. در این صورت محلولی بسیار کم رنگ پدید میآید که انگار رنگی ندارد. ظاهر بیرنگ آن نشان میدهد که محلول بسیار رقیق بوده و مقدار حلشونده در آن بسیار کم است.
برای بیان سادهتر غلظت محلولهای بسیار رقیق مانند غلظت کاتیونها و آنیونها، از کمیتی به نام قسمت در میلیون (ppm) استفاده میشود. با این کمیت میتوان غلظت محلولها را در آب معدنی، آب آشامیدنی، آب دریا، بدن جانداران، بافتهای گیاهی و مقدار آلایندههای هوا بیان کرد. این کمیت نشان میدهد که در یک میلیون گرم از محلول، چند گرم حلشونده وجود دارد.
از رابطه زیر میتوان ppm را بهدست آورد:
توجه کنید در این رابطه، یکای جرم در صورت و مخرج کسر باید یکسان باشد.
نمونه حل شده
در یک نمونه آب آشامیدنی به جرم 200 گرم، 5 صدم میلیگرم یون فلوئورید وجود دارد. غلظت یون –F در این نمونه چند ppm است؟
پاسخ:
با هم بیندیشیم صفحه 96
مربی آزمایشگاه پس از قرار دادن بشر روی ترازو، جرم آن را روی صفر تنظیم نمود. سپس با افزودن مقدار معینی پتاسیم کلرید (حلشونده) و آب (حلال)، محلولی تهیه کرد. با توجه به شکلهای زیر، به پرسشها پاسخ دهید.
آ) جرم حلشونده، محلول و حلال را تعیین کنید.
طبق عکس میبینیم که جرم حلشونده 8 گرم و جرم محلول 50 گرم است. با کم کردن جرم حلشونده از جرم محلول، جرم حلال بهدست میآید که برابر 42 گرم است.
ب) برای تهیه 100 گرم از این محلول به چند گرم حلشونده و چند گرم حلال نیاز است؟
این سوال را از دو روش میتوان پاسخ داد.
روش اول
روش دوم
پ) غلظت پتاسیم کلرید در این محلول 16 درصد جرمی است. با این توصیف، مفهوم درصد جرمی را توضیح دهید.
درصد جرمی محلول در واقع، گرم ماده حلشونده را در 100 گرم محلول نشان میدهد.
ت) رابطهای برای محسابه درصد جرمی محلول بیابید.
ث) بر روی ظرف حاوی محلول شستوشوی دهان عبارت «محلول استریل سدیم کلرید 0.9 درصد» نوشته شده است. معنی این عبارت را توضیح دهید.
این جمله نشان میدهد که از هر 100 گرم محلول استریل سدیم کلرید، 0.9 درصد آن NaCl و باقیمانده آن آب (حلال) است.
خود را بیازمایید صفحه 96
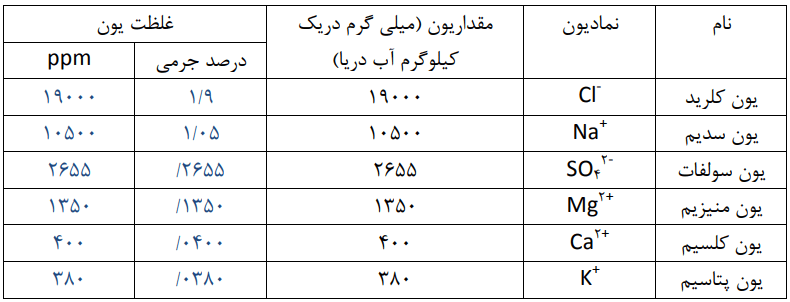
1- جدول زیر غلظت برخی یونها را در یک نمونه از آب دریا نشان میدهد. آن را کامل کنید.
جدولی که در کتاب درسی آمده است، بهصورت زیر کامل میشود.
2- جرم کل آبهای زمین در حدود 1018*1.5 تن است. اگر مقدار نمکهای حلشده در این آبها برابر با 3.5 درصد باشد، حساب کنید چند تن از انواع نمک در آنها وجود دارد؟
3- با توجه به شکل، درصد جرمی قند موجود در هر یک از نوشابههای گازدار را تعیین کنید.
پیوند با صنعت
دریا یکی از نعمتهای خدادادی است که منبعی سرشار از مواد شیمیایی است. در آب دریا در حدود 1016*5 تن از انواع مواد گوناگون وجود دارد.
گرمای شدید، سبب تبخیر آب دریاچهها و دریاها شده، در نتیجه بلورهای جامد زیبایی تشکیل میشود. بلورهایی که شامل انواع نمکها هستند.
تبلور
مواد شیمیایی موجود در آب دریا را میتوان به روشهای فیزیکی یا شیمیایی از آن جدا کرد. مثلا سالانه میلیونها تن سدیم کلرید با روش تبلور از آب دریا جداسازی و استخراج میشود.
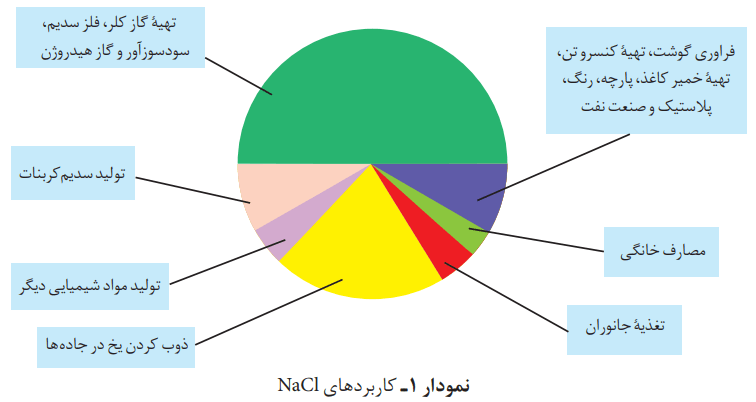
کاربردهای نمک خوراکی
نمک خوراکی در زندگی روزانه و صنایع گوناگون، کاربردهای فراوانی دارد.
از کاربردهای نمک خوراکی میتوان به موارد زیر اشاره کرد:
- فراوری گوشت، تهیه کنسرو تن، تهیه خمیر کاغذ، پارچه، رنگ، پلاستیک و صنعت نفت
- مصارف خانگی
- تغذیه جانوران
- تهیه گاز کلر، فلز سدیم، سود سوزآور و گاز هیدروژن
- تولید سدیم کربنات
- ذوب کردن یخ در جادهها
- و تولید مواد شیمیایی دیگر
کاربرد و منابع تهیه فلز منیزیم
فلز منیزیم ماده ارزشمند دیگری است که در تهیه آلیاژها، شربت معده و … کاربرد دارد.
یکی از منابع تهیه این فلز آب دریاست. منیزیم در آب دریا بهشکل (aq) +Mg2 وجود دارد. برای استخراج و جداسازی آن، در مرحله نخست منیزیم را بهصورت ماده جامد و نامحلول Mg(OH)2 رسوب میدهند. سپس آن را به منزیم کلرید تبدیل میکنند. در پایان با استفاده از جریان برق، منیزیم کلرید مذاب را به عنصرهای سازنده آن تجزیه میکنند.
MgCl2(l) → Mg(l) + Cl2(g)
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 3 شیمی 10، روی لینک های زیر کلیک کنید: