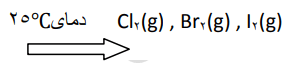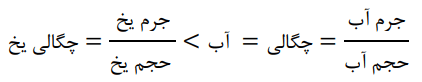- آموزش ویدیویی فصل سوم شیمی دهم جلسه 4
- رفتار آب و دیگر مولکولها در میدان الکتریکی؛ جلسه 4 فصل 3 شیمی دهم
- نیروهای بین مولکولی آب، فراتر از انتظار
- پیوندهای هیدروژنی در حالتهای فیزیکی گوناگون آب
- آب و دیگر حلالها
- کدام مواد با یکدیگر محلول میسازند؟
- فرایند انحلال نمکها در آب
- آیا گازها هم در آب حل میشوند؟
- ردپای آب در زندگی
آموزش جلسه 4 فصل 3 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
در جلسه قبل با مولاریته و انحلالپذیری آشنا شدیم. قرار است در این جلسه به بررسی نیروهای بین مولکولی و روشهای تصفیه آب بپردازیم.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل سوم شیمی دهم جلسه 4
در این قسمت، بخشی از «آموزش جلسه چهارم فصل سوم شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
در ابتدا با رفتار آب و دیگر مولکولها در میدان الکتریکی آشنا میشویم. پس از آن به بررسی نیروهای بین مولکولی و پیوندهای هیدروژنی آب میپردازیم. به نظر شما کدام مواد با یکدیگر محلول میسازند؟ در ادامه پس از آشنایی با فرایند انحلال نمکها در آب، با این پرسش مواجه میشویم که آیا گازها هم در آب حل میشوند؟ مبحث آخر به ردپای آب در زندگی اختصاص دارد.
رفتار آب و دیگر مولکولها در میدان الکتریکی؛ جلسه 4 فصل 3 شیمی دهم
آب تنها مادهای است که به هر سه حالت جامد، مایع و گاز (بخار) در طبیعت یافت میشود. وجود و تبدیل این حالتها به یکدیگر زندگی را در سیاره آبی ممکن و دلپذیر ساخته است. آب ویژگیهای گوناگون و شگفتانگیزی دارد. از جمله آنها توانایی حل کردن اغلب مواد، افزایش حجم هنگام انجماد و داشتن نقظه جوش بالا و غیر عادی است. به نظر شما این ویژگیها چه تاثیری روی زندگی موجودات زنده دارند؟ برای پاسخ به این پرسشها، بررسی ساختار مولکولی آب ضروری به نظر میرسد.
بررسی ساختار مولکولی آب
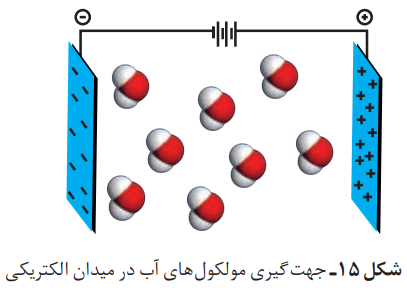
آزمایش انحراف باریکه آب توسط شانه یا میله مالش داده شده به موهای خشک را در نظر بگیرید. در این آزمایش، باریکه آب از راستای طبیعی خود منحرف میشود. دلیل این انحراف چیست؟ میله شیشهای از لحاظ بار الکتریکی خنثی است، اما بر اثر مالش به موی خشک، دارای بار الکتریکی منفی خواهد شد. در این شرایط، مولکولهای آب به سوی آن جذب میشوند.
این رفتار مولکولهای آب از ویژگیهای ساختاری آن سرچشمه میگیرد. شکل مولکول آب خمیده (V شکل) بوده و در آن هر اتم هیدروژن با یک پیوند اشتراکی یگانه به اتم مرکزی (اکسیژن) متصل است.
نوع اتمهای سازنده و ساختار خمیده مولکولهای آب، نقش تعیین کنندهای در خواص آن دارد. هنگامی که این مولکولها در یک میدان الکتریکی قرار میگیرند، جهتگیری میکنند.
مولکولهای قطبی و ناقطبی
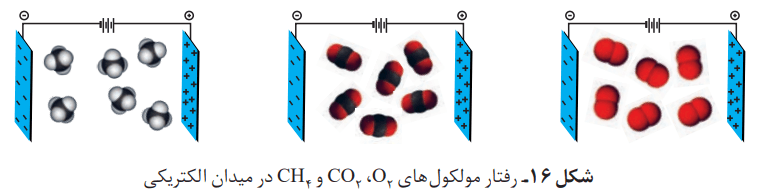
از نحوه جهتگیری مولکولهای آب در میدان الکتریکی میتوان یک نکته را فهمید. اتم اکسیژن، سَرِ منفی و اتمهای هیدروژن، سرِ مثبت مولکول را تشکیل میدهند. مولکولهایی مانند آب که در میدان الکتریکی جهتگیری میکنند، مولکولهای دوقطبی یا قطبی نام دارند. با این حال مولکولهای سازنده بعضی از ترکیبها در میدان الکتریکی جهتگیری نمیکنند. از این مولکولها میتوان به موارد زیر اشاره کرد:
- گاز اکسیژن (O2)
- کربن دی اکسید (CO2)
- متان (CH4)
به مولکولهایی که تحت تاثیر میدان الکتریکی جهتگیری نمیکنند، ناقطبی میگویند.
با هم بیندیشیم صفحه 104
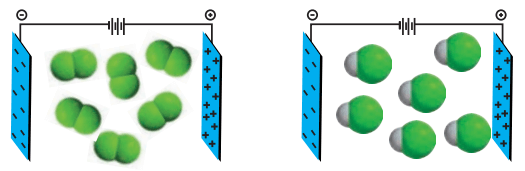
1- شکل زیر مولکولهای F2 و HCl با جرم مولی نزدیک به یکدیگر را در یک میدان الکتریکی نشان میدهد.
آ) کدام یک دارای مولکولهای قطبی است؟ چرا؟
HCl، زیرا مولکولهای آن در میدان الکتریکی جهتگیری کردهاند.
ب) اگر نقطه جوش F2 و HCl به ترتیب برابر با 188- و 85- درجه سانتیگراد باشد، نیروهای بینمولکولی در کدامیک قویتر است؟ توضیح دهید.
همانطور که میبینیم دمای جوش HCl بالاتر از F2 است. برای غلبه بر نیروهای بینمولکولی در HCl و تبدیل آن از حالت مایع به بخار، انرژی گرمایی بیشتری نسبت به F2 نیاز است. نیروهای بینمولکولی در میان مولکولهای قطبی HCl قویتر از مولکولهای ناقطبی F2 با جرم مولی مشابه است.
پ) جمله زیر را با خطزدن واژههای نادرست، کامل کنید.
در مواد مولکولی با جرم مولی مشابه، ماده با مولکولهای قطبی، نقطه جوش بالاتری دارد.
2- جرم مولی گازهای نیتروژن (N2) و کربن مونوکسید (CO) برابر است، بر این اساس:
آ) پیشبینی کنید مولکولهای دو اتمی کدام گاز در میدان الکتریکی جهتگیری میکند؟ چرا؟
انتظار میرود مولکول دو اتمی CO (برخلاف N2) در میدان الکتریکی جهتگیری کنند. مولکولهای دو اتمی که از اتصال اتمهای گوناگون (اتمهای ناجورهسته) تشکیل میشوند، در میدان الکتریکی جهتگیری کرده و قطبی هستند.
ب) کدام یک در شرایط یکسان آسانتر به مایع تبدیل میشود؟ توضیح دهید.
هرچه نیروهای بینمولکولی مادهای قویتر باشد، آن ماده در شرایط یکسان در دمای بالاتری به جوش میآید. اگر مواد در حالت گاز باشند، شرایط را میتوان اینگونه توصیف کرد. هرچه نیروهای بینمولکولی قویتر باشند، مولکولها را بهتر در کنار یکدیگر نگه داشته و آب نیز به مایع تبدیل میشود. دلیلش اینست که در میان مولکولهای قطبی CO جاذبه قویتری نسبت به مولکولهای ناقطبی N2 برقرار میشود.
خود را بیازمایید صفحه 105
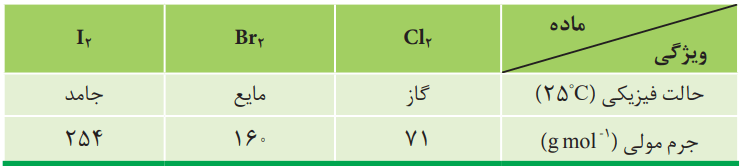
با توجه به جدول زیر، به پرسشها پاسخ دهید.
آ) آیا مولکولهای سازنده این مواد در میدان الکتریکی جهتگیری میکنند؟ چرا؟
خیر، زیرا از مولکولهای دو اتمی با اتمهای یکسان تشکیل شدهاند. چنین مولکولهایی ناقطبی بوده و در میدان الکتریکی جهتگیری نمیکنند.
ب) نیروهای بینمولکولی در کدام یک قویتر است؟ توضیح دهید.
حالت فیزیکی، میتواند کمیتی برای مقایسه قدرت نیروهای جاذبه بینمولکولی در شرایط یکسان باشد. با این توصیف، نیروهای بینمولکولی در ید، قویتر از برم و برم هم قویتر از کلر است.
موادی در دمای محیط گازی شکل هستند که دمای جوش آنها از دمای محیط کمتر باشد. تمام موادی که دمای ذوب آنها از دمای محیط کمتر باشد، در دمای محیط بهصورت مایع هستند. موادی در دمای محیط جامد هستند که دمای ذوب آنها از دمای محیط بالاتر باشد.
پ) جمله زیر را با خطزدن واژههای نادرست، کامل کنید.
در مواد مولکولی با مولکولهای ناقطبی، با افزایش جرم مولی، دمای جوش افزایش مییابد.
نیروهای بین مولکولی آب، فراتر از انتظار
به برهم کنشهای میان مولکولهای سازنده یک ماده، نیروهای بین مولکولی میگویند. ذرههای سازنده گاز به یکدیگر این نیرو را وارد میکنند. این نیروها مولکولهای مواد به حالت مایع و جامد را هم در کنار یکدیگر نگه میدارد.
نیروهای بین مولکولی در تعیین حالت فیزیکی و خواص یک ترکیب نقش مهمی دارند. گازها، دارای مولکولهای مجزا با کمترین برهم کنشها هستند. برهم کنش مولکولها در مایعها بیشتر است. در جامدها، برهم کنشها میان مولکولها میتواند به بیشترین مقدار ممکن برسد. در شرایط یکسان، نیروهای بینمولکولی در حالت جامد قویتر از مایع و آن هم به مراتب قویتر از حالت گازی است. نیروهای بین مولکولی بهطور عمده به میزان قطبی بودن مولکولها و جرم آنها وابسته است.
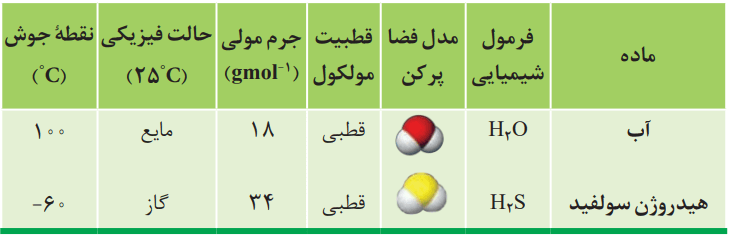
برخی ویژگیهای آب در مقایسه با هیدروژن سولفید را میتوانید در جدول زیر ببینید.
مطابق جدول، هر دو ماده مولکولهای خمیده و قطبی دارند. آب با جرم مولی نزدیک به نصف جرم مولی هیدروژن سولفید، دمای جوش غیرعادی و بالاتری از آن دارد. این تفاوت در حدود 160 درجه سانتیگراد است. انگار نیروی جاذبه میان مولکولهای آب از آنچه انتظار میرود، قویتر است. دلیل این تفاوت چه میتواند باشد؟
گشتاور دوقطبی
میدانیم که مولکولهای قطبی یک ماده در میدان الکتریکی جهتگیری میکنند. این ویژگی مبنای اندازهگیری کمیتی بهنام گشتاور دوقطبی است؛ کمیتی تجربی که با افزایش میزان قطبیت مولکولها، افزایش مییابد. برای نمونه گشتاور دوقطبی مولکولهایی مانند O2، CO2 و CH4 برابر با صفر است. با این حال گشتاور دوقطبی مولکولهای H2O و H2S بهترتیب برابر با 1.85D و 0.97D است.
گشتاور دوقطبی مولکولها را با یکای دبای (D) گزارش میکنند.
این کمیتها نشان میدهند که میزان قطبیت مولکولهای آب و قدرت نیروهای بینمولکولی آن نزدیک به دو برابر مولکولهای هیدوژنسولفید است. نیزوهای جاذبه میان مولکولهای H2O واقعا قوی است. بهقدری که در شرایط اتاق میتواند این مولکولها را کنار یکدیگر نگه دارد و آب به حالت مایع باشد.
پیوندهای هیدروژنی
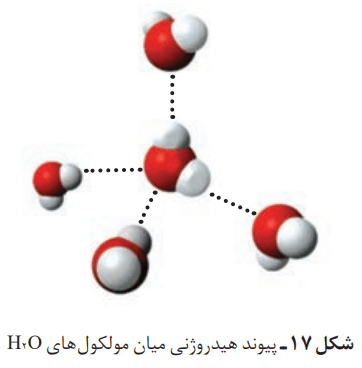
بارهای الکتریکی ناهمنام یکدیگر را میربایند. در آبی با شمار زیاد مولکولهای H2O، سر مثبت هر مولکول، سر منفی مولکول همسایه را جذب میکند. هر اتم هیدروژن با یک نیروی جاذبه قوی از سوی اتم اکسیژن در مولکول همسایه جذب میشود. این نیروهای جاذبه قوی میان مولکولهای آب که در آن هیدروژن نقش کلیدی ایفا میکند، پیوندهای هیدروژنی نام دارند.
آیا تنها میان مولکولهای H2O پیوند هیدروژنی وجود دارد؟ یا اینکه مولکولهای دیگر نیز میتوانند پیوند هیدروژنی تشکیل دهند؟
به جز پیوندهای هیدروژنی، به نیروهای جاذبه بین مولکولی، نیروهای واندروالس میگویند.
با هم بیندیشیم صفحه 107
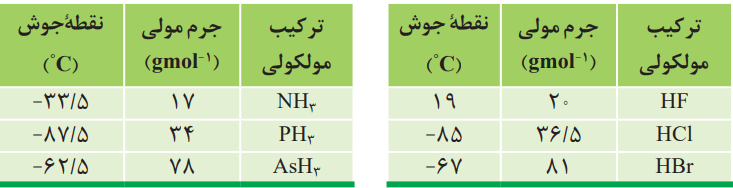
1- دو جدول زیر برخی خواص ترکیبهای هیدروژندار عنصرهای گروه 15 و 17 جدول دورهای را نشان میدهند.
آ) در میان ترکیبهای هر جدول انتظار دارید مولکولهای کدام ماده توانایی تشکیل پیوندهای هیدروژنی را داشته باشد؟ توضیح دهید.
در جدول سمت چپ، NH3 و در جدول سمت راست HF. دمای جوش هر یک از آنها با جرم مولی کمتر نسبت به ترکیبات مشابهشان بهطور غیرعادی بالاتر است.
ب) جمله زیر را با خطزدن واژههای نادرست، کامل کنید.
پیوند هیدروژنی، قویترین نیروی بینمولکولی در موادی است که در مولکول آنها، اتم هیدروژن به یکی از اتمهای F، N و O با پیوند اشتراکی متصل است.
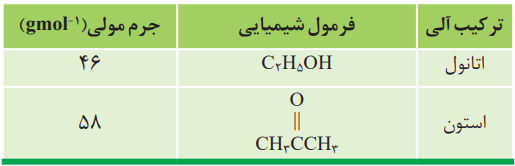
2- اتانول و استون دو ترکیب آلی اکسیژندار هستند که به عنوان حلال در صنعت و آزمایشگاه به کار میروند. به کمک دادههای جدول زیر پیشبینی کنید هریک از نقطهجوشهای 56 و 78 درجه سانتیگراد مربوط به کدام ترکیب است؟ چرا؟
در ساختار اتانول برخلاف استون، هیدروژن با پیوند کووالانسی به اتم اکسیژن متصل است. چون میان مولکولهای آن پیوندهای قوی هیدروژنی وجود دارد، باید دمای جوش بالاتری از استون داشته باشد. در واقع دمای جوش 78 درجه مربوط به اتانول و 56 درجه مربوط به استون است.
پیوندهای هیدروژنی در حالتهای فیزیکی گوناگون آب
آب را در سه حالت فیزیکی جامد (یخ)، مایع و بخار در نظر بگیرید. مولکولهای H2O در حالت بخار جدا از هم هستند، گویی پیوندهای هیدروژنی میان آنها وجود ندارد. در این حالت، مولکولهای آب آزادانه و نامنظم از جایی به جای دیگر انتقال مییابند. در حالت مایع علیرغم وجود پیوندهای هیدروژنی قوی، مولکولها روی هم میلغزند و جابهجا میشوند. برخلاف آب، ساختار یخ منظم است. حالت یخ H2O، مولکولهای آب در جاهای به نسبت ثابتی قرار دارند. در ساختار یخ، هر اتم اکسیژن به دو اتم هیدروژن با پیوند اشتراکی و به دو اتم هیدروژن دیگر با پیوند هیدروژنی متصل است.
در ساختار یخ، اتمهای اکسیژن در راس حلقههای شش ضلعی قرار دارند و شبکهای مانند کندوی زنبور عسل را بهوجود میآورند. این شبکه با داشتن فضاهای خالی منظم، در سه بُعد گسترش یافته است. شکلهای زیبا و متنوع دانههای برف ناشی از وجود این حلقههای ششضلعی است.
خود را بیازمایید صفحه 108
با توجه به شکلهای زیر به پرسشها پاسخ دهید.
آ) با نوشتن دلیل، چگالی جرم یکسانی از آب و یخ را در دمای صفر درجه سلسیوس و فشار یک اتمسفر مقایسه گنید.
چون ضمن تبدیل آب به یخ، جرم ثابت است ولی حجم بیشتر میشود؛ چگالی یخ از آب کمتر است.
در این رابطهها، صورتها مساوی ولی مخرجها متفاوت است.
ب) چرا دیواره یاختهها در بافت کلم بر اثر یخ زدن تخریب میشوند؟
یاختههای کلم، هنگام انجماد و تبدیل شدن به یخ، با افزایش حجم روبرو میشوند. این کار باعث پاره شدن دیواره یاختهها و در نهایت منجر به تخریب بافت گیاهی میشود.
آب و دیگر حلالها
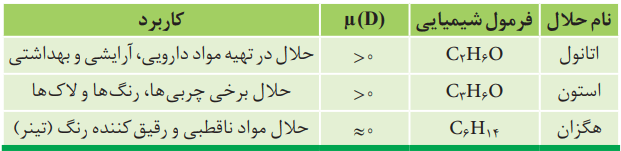
آب فراوانترین و رایجترین حلال در طبیعت، صنعت و آزمایشگاه است. این ماده میتواند بسیاری از ترکیبهای یونی و مواد مولکولی را در خود حل کند. آب و محلولهای آبی در زندگی جانداران نقش حیاتی دارند؛ اما، همه محلولها آبی نیستند. افزون بر آب، حلالهای دیگری نیز وجود دارند. در جدول پایین سه ترکیب آلی را میبینید که به عنوان حلال به کار میروند.
به محلولهایی که حلال آنها آلی است، محلولهای غیر آبی میگویند. در شکل پایین دو نمونه محلول غیر آبی آورده شده است.
خود را بیازمایید صفحه 109
آیا حالت فیزیکی و ترکیب شیمیایی در سرتاسر هریک از مخلوطهای زیر یکسان و یکنواخت است؟ چرا؟
در ظرف (آ) حالت فیزیکی در سرتاسر مخلوط یکسان نیست.یخ حالت جامد و آب حالت مایع دارد و مرز میان آب و یخ قابل تشخیص است. با این حال ترکیب شیمیایی یا ذرات سازنده هر دو H2O بوده و یکسان است.
در ظرف (ب) حالت فیزیکی در سرتاسر محلول یکسان است. آب و هگزان هردو به حالت مایع هستند، اما ترکیب شیمیایی متفاوت است. هگزان از مولکولهای ناقطبی اما آب از مولکولهای قطبی تشکیل شده است و مرز میان هگزان و آب، قابل تشخیص است.
توجه: آب و یخ ماده خالص، ولی آب و هگزان ماده ناخالص یا مخلوط است.
پیوند با زندگی صفحه 110
اغلب محلولهای موجود در بدن انسان، محلولهای آبی هستند. بیشتر واکنشهای شیمیایی درون بدن از جمله گوارش غذا، کنترل دمای بدن، تنفس، جلوگیری از خشکی پوست و … در آنها انجام میشود. با این توصیف، بخش عمده جرم بدن را آب تشکیل میدهد. بیش از نیمی از این آب در درون یاختهها و باقی آن در مایعهای برون سلولی جریان دارد. این مایعها مواد مغذی و مواد زائد را بین سلولها و دستگاه گردش خون جابهجا میکند.
هر فرد بالغ روزانه به طور میانگین 1500 تا 3000 میلی لیتر آب از دست میدهد. از دست دادن آب از راههای متفاوتی انجام میشود که بعضی از آنها از این قرارند:
- ادرار
- تعرق پوستی
- بخار آب در بازدم و …
اگر این مقدار آب با خوردن مواد غذایی، میوهها و نوشیدنیها جبران نشود، بدن دچار کم آبی خواهد شد.
آب با حل کردن مواد زائد تولید شده در سلولها و دفع آنها، نقش کلیدی در حفظ سلامت بدن دارد.
کدام مواد با یکدیگر محلول میسازند؟
برخی حلشوندهها در برخی حلالها حل میشوند و محلول تشکیل میدهند، در حالی که برخی دیگر مخلوط ناهمگن میسازند.
افزودن استون به آب یا اندکی یُد به هگزان منجر به تشکیل محلول میشود اما، افزودن هگزان به آب، مخلوطی ناهمگن پدید میآورد.
با هم بیندیشیم صفحه 111
با هم بیندیشیم صفحه 111 شیمی دهم، دارای سه سوال است که در ادامه به آنها میپردازیم.
سوال 1
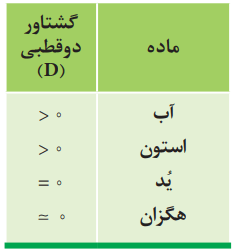
با توجه به مقدار گشتاور دوقطبی هر ماده، موارد زیر را توجیه کنید.
آ) انحلال استون در آب ب) انحلال یُد در هگزان پ) حل نشدن هگزان در آب
آ) آب و استون هردو از مولکولهای قطبی تشکیل شدهاند. طبق دادههای تجربی گشتاور دوقطبی دارند، از اینرو استون در آب حل میشود.
ب) ید و هگزان طبق دادههای تجربی هردو از مولکولهای ناقطبی تشکیل شدهاند. چون گشتاور دوقطبی آنها صفر است، از اینرو ید در هگزان حل میشود.
پ) هگزان با گشتاور دوقطبی ضفر، مولکولهای ناقطبی دارد. آب با گشتاور دوقطبی بزرگتر از صفر، دارای مولکولهای قطبی است. از اینرو هگزان ناقطبی در آب قطبی حل نمیشود، بنابراین یک مخلوط ناهمگن پدید میآید.
سوال 2
آیا جمله «شبیه، شبیه را حل میکند» درست است؟ توضیح دهید.
بله. حلشوندههای قطبی در حلالهای قطبی و حلشوندههای ناقطبی در حلالهای ناقطبی بهتر حل میشوند.
سوال 3
آزمایشها نشان میدهند که فرایند انحلال هنگامی منجر به تشکیل محلول میشود که:
(میانگین جاذبهها در حلال خالص و حلشونده خالص) < (جاذبههای حلشونده با حلال در محلول)
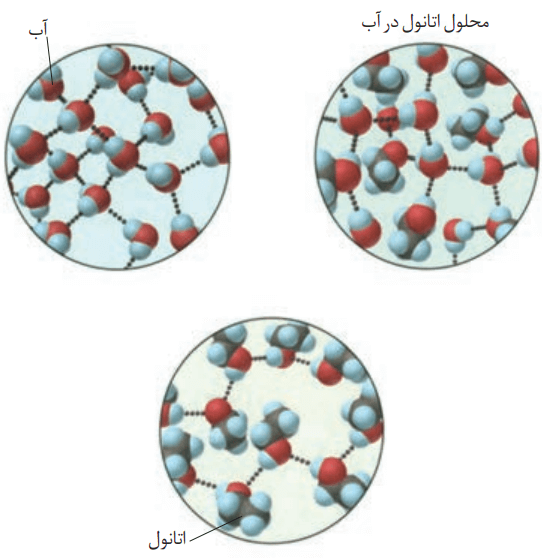
با این توصیف با توجه به شکل زیر، به پرسشهای مطرح شده پاسخ دهید.
آ) نیروهای بین مولکولی در هر یک از چه نوعی است؟ چرا؟
هم در مولکول آب و هم در مولکول اتانول، اتم هیدروژن با پیوند اشتراکی به اتم اکسیژن متصل است. در میان مولکولهای آب خالص، اتانول خالص و همچنین میان مولکولهای اتانول با آب در حالت محلول، پیوندهای هیدروژنی وجود دارد.
ب) در مربع زیر علامت <یا> قرار دهید.
لازمه انحلال اتانول در آب، شکسته شدن پیوند هیدروژنی میان مولکولهای اتانول-اتانول و آب-آب است. میدانیم که اتانول در آب حل میشود. از اینرو مجموع انرژی حاصل از تشکیل پیوند هیدروژنی جدید میان مولکولهای آب و اتانول توانسته است پیوندهای هیدروژنی اولیه را بشکند.
پس:
میانگین انرژی پیوند میان آب و اتانول ≥ میانگین انرژی پیوند هیدروژنی آب-آب و اتانول-اتانول
دمای جوش آب از دمای جوش اتانول بیشتر است. میتوان گفت انرژی پیوند هیدروژنی میان مولکولهای آب از انرژی پیوند هیدروژنی میان مولکولهای اتانول بیشتر است. برای به جوش آوردن یک مایع باید بر جاذبه میان مولکولهای مایع غلبه کرده و آنها را از مایع جدا و خارج نمود.
پ) چرا شیمیدانها انحلال اتانول در آب را انحلال مولکولی مینامند؟ توضیح دهید.
با انحلال اتانول در آب، ساختار مولکولی اتانول (C2H5OH) دچار تغییر، تبدیل یا تخریب نمیشود. این ماده با همان ساختار مولکولی در میان مولکولهای حلال (آب) فقط با تشکیل پیوندهای هیدروژنی جدید پراکنده شده است.
فرایند انحلال نمکها در آب
تا اینجای کار با انحلال مولکولی آشنا شدیم. انحلالی که در آن مولکولهای حلشونده، ماهیت خود را در محلول حفظ میکنند. انگار ساختار مولکولهای حلشونده در محلول دچار تغییر نشده است.
انحلال استون یا اتانول در آب و نیز انحلال یُد در هگزان از این نوع هستند. با این حال همه فرایندهای انحلال چنین نیستند. برای نمونه به فرایند انحلال سدیم کلرید در آب توجه کنید.
انحلال یونی
سدیم کلرید یک ترکیب یونی با بلورهای مکعبی است که در آن یونهای +Na و –Cl با آرایشی منظم در سه بعد جای گرفتهاند. در نظر بگیرید که بلور کوچکی ازین ماده جامد در آب وارد میشود. مولکولهای قطبی آب از سرهای مخالف به یونهای بیرونی بلور نزدیک شده و نیروی جاذبهای میان آنها برقرار میشود.
این نیروی جاذبه، یون-دوقطبی نام دارد. نیروی جاذبهای که باعث جدا شدن یونها از شبکه شده تا با لایهای از مولکولهای آب، پوشیده شوند. این یونهای آبپوشیده در سرتاسر محلول پراکنده خواهند شد. طوری که محلول آب نمک را میتوان محلولی محتوی یونهای سدیم و کلرید دانست.
در این فرایند انحلال، ماده حلشونده ویژگی ساختاری خود را حفظ نمیکند و یونهای سازنده شبکه بلور یونی، تفکیک و آبپوشیده شدهاند. این فرایند، انحلال یونی به شمار میرود.
خود را بیازمایید صفحه 112
1- در معادله انحلال هر یک از ترکیبهای یونی زیر، جاهای خالی را پر کنید.
آ)
Al(NO3)3(s) → Al3+(aq) + 3NO–3(aq)
ب)
BaCl2(s) → Ba2+(aq) + 2Cl–(aq)
تذکر: ضمن انحلال ترکیب یونی در آب، سمت چپ یا قسمت فلزی به یون مثبت و سمت راست یا قسمت نافلزی به یون منفی تبدیل میشود. زیروندها به ضریب و بار الکتریکی یون به عنوان توان یون به کار میرود.
2- منیزیم سولفات و باریم سولفات در دمای 25 درجه سانتیگراد، به ترتیب محلول و نامحلول در آب هستند. با توجه به این قضیه، با دلیل در هر مربع علامت <یا> قرار دهید.
این سوال دارای دو بخش آ و ب است که بهصورت زیر پاسخ داده میشوند.
عمل انحلال میتواند در حالتی اتفاق بیافتد که چنین شرطی برقرار شود. جاذبه میان ذرات حلشونده و حلال در مجموع از میانگین جاذبه میان ذرات حلال و جاذبه میان ذرات حلشونده بیشتر یا مساوی باشد.
با این حساب:
آیا گازها هم در آب حل میشوند؟
آیا تاکنون به تنفس ماهیهای درون آبزیدان (آکواریوم) توجه کردید؟ بهنظر شما آبزیان اکسیژن لازم برای سوخت و ساز را از کجا تامین میکنند؟ همه جانوران از جمله ماهیها برای زنده ماندن به اکسیژن (O2) نیازمندند. آنها با عبور دادن آب از درون آبشش خود، اکسیژن مولکولی حل شده در آب را جذب میکنند. با اینکه گاز اکسیژن به میزان کمی در آب حل میشود، اما همین مقدار کم برای زندگی آبزیان نقش حیاتی دارد. آیا میدانید انحلالپذیری گاز اکسیژن و دیگر گازها در آب به چه عواملی بستگی دارد؟
با هم بیندیشیم صفحه 114
با هم بیندیشیم صفحه 114 شیمی دهم دارای دو سوال است که در ادامه به آنها میپردازیم.
سوال 1
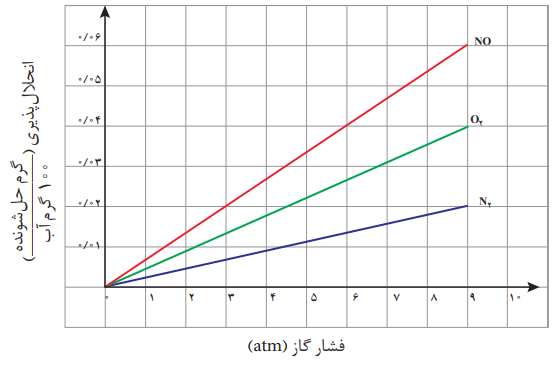
نمودار زیر انحلالپذیری سه گاز را که با آب واکنش شیمیایی نمیدهند در دمای 20 درجه سانتیگراد نشان میدهد. با توجه به آن، به پرسشهای مطرح شده پاسخ دهید.
آ) این نمودار تاثیر چه عاملی را بر انحلالپذیری گازها نشان میدهد؟ توضیح دهید.
تاثیر فشار گاز بر میزان انحلالپذیری این گازها را در دمای ثابت نشان میدهد. هر چه فشار گاز در دمای ثابت افزایش یابد، میزان انحلالپذیری گاز در آب بیشتر میشود.
ب) نتیجهگیری از این نمودار، «قانون هنری» نام دارد. آن را در یک سطر توضیح دهید.
قانون هنری را اینگونه میشود توضیح داد. میزان انحلالپذیری یک گاز در آب، با فشار گاز در دمای ثابت رابطه مستقیم دارد.
پ) شیب نمودار برای کدام گاز تندتر است؟ از این واقعیت چه نتیجهای میگیرید؟
برای گاز NO شیب نمودار تندتر است. در واقع با افزایش فشار گاز NO در دمای ثابت، افزایش انحلالپذیری محسوستر است. این گاز برخلاف N2 و O2 از مولکولهای قطبی تشکیل شده است.
سوال 2
با توجه به اینکه گشتاور دوقطبی CO2 برخلاف NO صفر است:
آ) پیشبینی کنید در دما و فشار معین، انحلالپذیری کدام گاز در آب بیشتر است؟ چرا؟
انتظار میرود NO با مولکولهای قطبی، انحلالپذیری بیشتری از CO2 با مولکولهای ناقطبی داشته باشد. دلیل آن به آب مربوط است. آب از مولکولهای قطبی تشکیل شده و مواد با مولکولهای قطبی را بهتر و بیشتر در خود حل میکند.
ب) آزمایشها نشان میدهد که در فشار یک اتمسفر و در هر دمایی، انحلالپذیری گاز CO2 بیشتر از NO است. چرا؟
انحلال NO در آب مولکولی است. مولکولهای CO2 در آب همراه با انحلال مولکولی، با انجام واکنش شیمیایی، محلول اسیدی تولید میکنند. انجام واکنش شیمیایی باعث میشود که انحلالپذیری CO2 در آب در شرایط یکسان از NO بیشتر باشد. علاوه بر آن مولکول CO2 از NO سنگینتر است که به انحلال بیشتر آن کمک میکند.
پیوند با زندگی صفحه 115
ورزشکاران بهویژه دوچرخه سواران و دوندگان پس از تمرین یا مسابقه، نوشیدنیهای ویژهای مصرف میکنند. هریک از این نوشیدنیها حاوی یک سری مواد مفید و ضروری هستند که مصرف آنها به ورزشکاران توصیه میشود.
بدن ما سامانه پیچیده و متعادلی از یاختهها، بافتها و مایعات است. اجزای این سامانه در هر لحظه با نظمی باور نکردنی، پیامهای عصبی، احساسات و حرکات ما را کنترل میکنند. این هنگامی رخ میدهد که محیط شیمیایی مناسبی برای ایجاد و برقراری جریان الکتریکی فراهم شود. این محیط یک محلول آبی محتوی یونهای گوناگونی مانند +Cl–، K+، Na و … است.
حتما پس از انجام یک فعالیت بدنی سنگین یا پس از مدتی دویدن، احساس خستگی کردهاید. این حس به دلیل کاهش چشمگیر این یونها در مایعهای بدن است. از اینرو نوشیدن محلولهایی حاوی این یونها ضروری است.
یکی از مهمترین یونها در مایعهای بدن، یون پتاسیم (+K) است. نیاز روزانه بدن هر فرد بالغ به یون پتاسیم، دو برابر یون سدیم است. چون بیشتر مواد غذایی حاوی یون پتاسیم است، کمبود آن بهندرت احساس میشود. وجود یون پتاسیم (+K) برای تنظیم و عملکرد مناسب دستگاه عصبی بسیار ضروری است. انتقال پیامهای عصبی بدون وجود این یون، امکانپذیر نیست.
اختلال در حرکت این یون، مانع از انتقال پیامهای عصبی و گاهی در موارد شدید، منجر به مرگ میشود.
ردپای آب در زندگی
- آیا میدانید روزانه چند لیتر آب مصرف میکنید؟
- آیا مصرف آب، تنها شامل میزان آبی است که مینوشید؟
هر فرد، روزانه در حدود 350 لیتر آب مصرف میکند. این مقدار افزون بر نوشیدن، شامل پخت و پز، شستشو در آشپزخانه، نظافت، شستشوی لباس و … است.
مصرف آب به فعالیتهای روزانه هر شخص محدود نمیشود؛ بلکه روزانه در صنایع گوناگون، حجم بسیار زیادی آب استفاده میشود. در میان صنایع، صنعت کشاورزی بیشترین حجم آب مصرفی را به خود اختصاص داده است. بررسیها نشان میدهند که برای تولید هر وسیله، کالا یا فراورده، به مقدار معینی از آب نیاز است.
مقدار آب مورد نیاز برای تولید بعضی از اقلام بهصورت زیر است:
- 100 گرم شکلات = 2400 لیتر
- یک کیلوگرم گوجهفرنگی = 180 لیتر
- یک بلوز نخی = 2700 لیتر
- یک کیلوگرم چرم = 16600 لیتر
همانند ردپای کربن دی اکسید، برای هر فرد، ردپای آب نیز تعریف میشود. با ردپای آب میفهمیم که هر فرد چه مقدار از آب قابل استفاده و در دسترس را مصرف میکند. همچنین این را هم نشان میدهد که چه مقدار از حجم منابع آب کم میشود. این میزان، همه آبی را که در تولید کالاها، ارائه خدمات و فعالیتهای گوناگون مصرف میشود را شامل میشود.
اگر شما سالانه 150 کیلوگرم گندم مصرف کنید، ردپای آب شما در تولید این مقدار گندم برابر با 274500 لیتر خواهد بود. نکتهای که وجود دارد، این است که شما گندم را بهشکل خام مصرف نمیکنید و آن را به فراورده قابل مصرف درمیآورید. با این حساب، مصرف 150 کیلوگرم گندم به شکل نهایی و آماده، مقدار آب بیشتری نیز مصرف خواهد کرد.
میانگین ردپای آب سالیانه برای هر فرد
با حساب کردن همه آب مصرفی در زندگی سالانه هر فرد، میتوان میانگین ردپای آب او را برآورد کرد. هر چه ردپای آب ایجاد شده سنگینتر باشد، منابع آب شیرین بیشتر مصرف میشوند و زودتر به پایان میرسند. تقریبا میانگین ردپای آب برای هر فرد در یک سال، چیزی در حدود 1000000 لیتر است.
این ردپا شامل همه آبهای مصرفی در کشاورزی، دامداری، نساجی، بهداشت، خانه، مدرسه، دانشگاه و … است. تمام اینها از آبهای سطحی یا زیرزمینی تامین میشود. آب آشامیدنی با آب مصرفی در دیگر صنایع متفاوت است. ممکن است آبی برای شستشو مناسب باشد، اما به درد آشامیدن نخورد. آب دریاها و اقیانوسها، منبع بسیار بزرگی برای تهیه آب به شمار میآیند. با این حال به اندازهای شور هستند که باید قبل از مصرف، نمکزدایی و تصفیه شوند.
پیوند با زندگی صفحه 117
هنگامی که حبوبات و میوههای خشک را برای مدتی درون آب قرار میدهیم، متورم میشوند. با این حال خیار در آب شور، چروکیده میگردد. به نظر شما چه اتفاقاتی در این پدیدهها رخ میدهد؟
مولکولهای آب خودبخود از محیط رقیق با گذر از روزنههای دیواره سلولی به محیط غلیظ میروند.
دلیل چروکیدگی خیار، اسمز یا گذرندگی است. در خیار آب از درون آن که یک محیط رقیق است، خودبخود به سمت محیط غلیظ که آب نمک است، میرود.
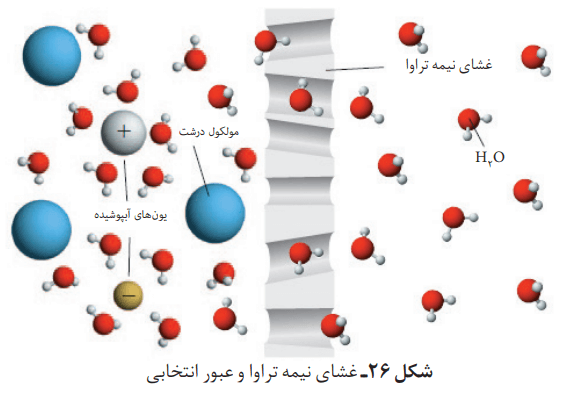
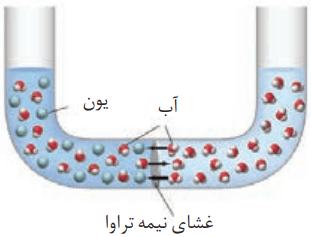
غشای نیمه تراوا
دیواره یاختهها در گیاهان روزنههایی بسیار ریز دارد که ذرههای سازنده مواد میتوانند از آن گذر کنند. این روزنهها فقط اجازه گذر به برخی از ذرهها و مولکولهای کوچک مانند آب و یونها را میدهند. در عین حال از گذر مولکولهای درشتتر جلوگیری میکنند. به این دیوارهها، غشای نیمه تراوا میگویند.
گذرندگی (اسمز)
در نظر بگیرید که میوههای خشک مانند مویز درون آب قرار بگیرند.مولکولهای آب در این هنگام، خود به خود از محیط رقیق با گذر از روزنههای دیواره سلولی به محیط غلیظ میروند. در نتیجه، میوه آبدار و متورم میشود.
گذرندگی (اسمز) نامی است که به این فرایند دادهاند. در این فرایند، برخی نمکها، ویتامینها و … از بافت میوه به آب راه مییابد.
با هم بیندیشیم صفحه 118
این بخش دارای دو سوال است که در سایت رپیتیچ آنها را با یکدیگر بررسی میکنیم.
سوال 1
مطابق شکل زیر، حجمهای برابری از آب دریا و آب مقطر بهوسیله یک غشای نیمه تراوا از یکدیگر جدا شدهاند.
آ) اگر این غشا مانع گذر یونهای سدیم و کلرید شود، با گذشت زمان چه رخ میدهد؟
با گذشت زمان تنها مولکولهای آب با عبور از غشای نیمه تراوا از آب خالص به سوی آب دریا مهاجرت میکنند. این فرایند به دلیل پدیده اسمز است.
ب) آیا با این روش میتوان آب دریا را نمکزدایی و آب شیرین تهیه کرد؟ چرا؟
خیر، با این روش آب خالص مصرف شده و آب دریا رقیقتر میشود. در واقع با این روش نمیتوان آب دریا را نمکزدایی کرد و به آب شیرین رسید.
پ) بر اساس شکل پایین، اگر بر پیستون نیرو وارد کنیم چه رخ میدهد؟ چرا؟
وارد کردن فشار به پیستون، مانع از مهاجرت خود به خود مولکولهای آب از آب خالص رقیقتر به آب دریا میشود. اگر فشار وارد شده به پیستون به یک حد معین برسد، مهاجرت مولکولهای آب از آب خالص به سوی محلول متوقف میشود. با این حساب از انجام روند معمولی پدیده اسمز جلوگیری میشود.
ت) چرا فرایند انجام شده در قسمت «پ» را اسمز وارونه (معکوس) مینامند؟
فرض کنید فشار وارد بر پیستون از یک حد معین فراتر رود. در این صورت مولکولهای H2O از آب دریا به سوی آب خالص مهاجرت میکنند. چون این پدیده خلاف جهت روند طبیعی پدیده اسمز رخ میدهد، از اینرو به آن اسمز معکوس میگویند.
سوال 2
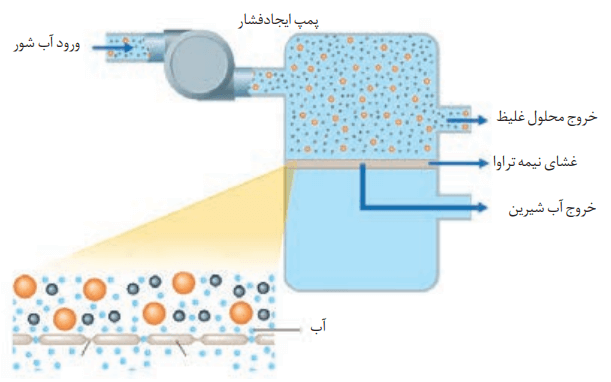
با توجه به شکل زیر، چگونگی تولید آب شیرین از آب دریا را توضیح دهید.
در ابتدا آب شور دریا از یک سو وارد دستگاه میشود. سپس با ایجاد فشار بیش از حد نیاز، مولکولهای H2O با عبور از غشای نیمه تراوا به سوی آب شیرین مهاجرت میکنند. همزمان محلول غلیظتر از سوی دیگر خارج میشود.
در واقع با اسمز معکوس میتوان از آب دریا نمکزدایی کرد. با این کار بهتدریج به حجم آب شیرین اضافه میشود و میتوان آب شور دریا را به آب شیرین تبدیل کرد.
خود را بیازمایید صفحه 119
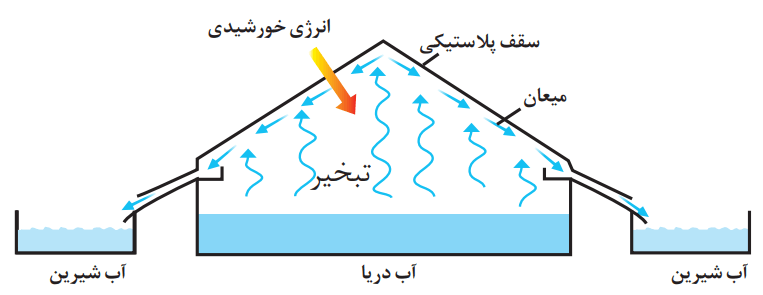
1- شکل زیر روشی برای تهیه آب شیرین از آب دریا را نشان میدهد.
آ) این روش چه نام دارد؟
روش تقطیر
ب) روند تهیه آب شیرین را در این روش توضیح دهید.
با تابش نور خورشید در تامین انرژی گرمایی، تنها مولکولهای آب از آب دریا تبخیر میشوند. این مولکولها با برخورد به دیواره ظرف سرد میشوند. در همین روند به آسانی مایع شده و با جریان یافتن روی سطح دیواره، در ظرف دیگری جمعآوری و ذخیره میشوند. به آب حاصل که فاقد مواد حلشونده گوناگون است، اصطلاحا آب شیرین میگویند.
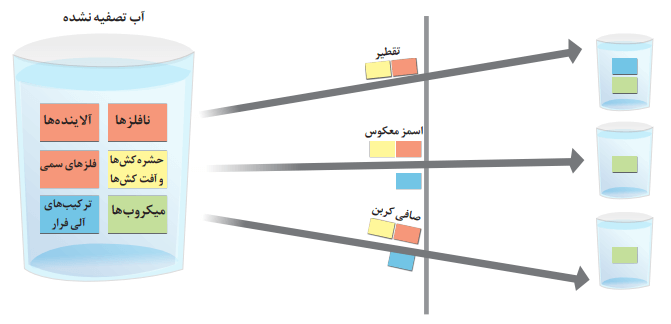
2- شکل زیر برخی روشهای تصفیه یک نمونه آب را نشان میدهد. با توجه به شکل به پرسشها پاسخ دهید.
آ) با انجام تقطیر، کدام مواد موجود در آب از آن جدا میشوند؟ توضیح دهید.
نافلزها، آلایندهها، حشرهکشها و آفتکشها، همچنین فلزهای سمی
ب) با عبور آب از صافی کربن، کدام آلایندهها حذف میشوند؟
همه آلایندهها به جز میکروبها حذف میشوند.
پ) با روش اسمز معکوس، کدام مواد را میتوان از آب جدا کرد؟
جواب این سوال، مشابه سوال قبلی است.
ت) آب بهدست آمده از کدام روشها، آلاینده کمتری دارد؟
اسمز معکوس و استفاده از صافی کربن
ث) چرا آب تصفیه شده در این روشها را باید پیش از مصرف کلرزنی کرد؟
زیرا میکروبهای موجود در آب جداشده، تنها با کلر که خاصیت گندزدایی دارد، از بین میروند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 3 شیمی 10، روی لینک های زیر کلیک کنید: