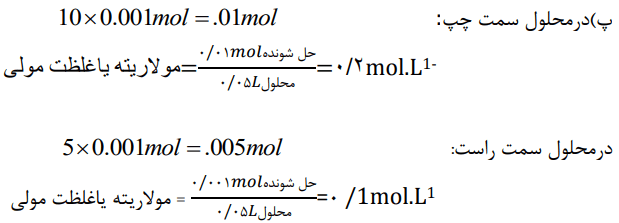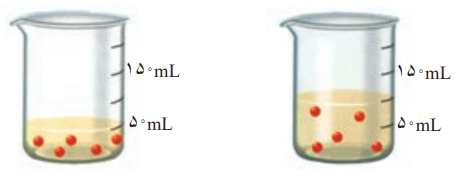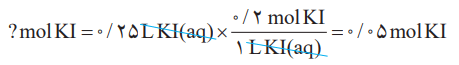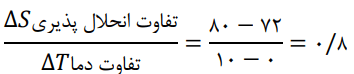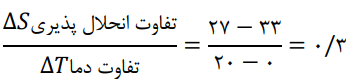آموزش جلسه 3 فصل 3 شیمی دهم بهصورت تستبیس، همراه با تدریس ویدیویی «دکتر متین هوشیار» را، در این پست از رپیتیچ ببینید.
در جلسه قبل با ppm و درصد جرمی آشنا شدیم. قرار است در این جلسه به بررسی غلظت مولی و انحلال پذیری نمکها بپردازیم.
خب، اول از همه بریم که ویدیوی آموزشی این بخش رو ببینیم.
آموزش ویدیویی فصل سوم شیمی دهم جلسه 3
در این قسمت، بخشی از «آموزش جلسه سوم فصل سوم شیمی دهم» را بهصورت ویدیویی میتوانید ببینید. مدرس این قسمت، آقای دکتر متین هوشیار، رتبه 127 کنکور تجربی هستند.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
در ابتدا با غلظت مولی یا مولار آشنا میشویم و یک نمونه حل شده را با همدیگر بررسی میکنیم. پس از آن با این سوال که «آیا نمکها به یک اندازه در آب حل میشوند» روبهرو میشویم. مبحث آخر به تاثیر دما بر میزان انحلال پذیری اختصاص دارد.
غلظت مولی (مولار)؛ جلسه 3 فصل 3 شیمی دهم
غلظت بسیاری از محلولها در صنعت، پزشکی، داروسازی، کشاورزی و زندگی روزانه با درصد جرمی بیان میشود. سرکه خوراکی با خاصیت اسیدی ملایم به عنوان چاشنی در غذاها مصرف میشود. این چاشنی در اصل، محلول 5 درصد جرمی استیکاسید در آب است. محلول غلیظ نیتریکاسید در صنعت با غلظت 70 درصد جرمی تولید و بسته به کاربرد آن، به محلولهای رقیقتر تبدیل میشود.
با این حال تهیه محلولها به حالت مایع، با درصد جرمی معین کار آسانی نیست. طبق تجربه اندازهگیری حجم یک مایع به ویژه در آزمایشگاه، آسانتر از جرم آن است.
شیمیدانها مقدار ماده را بر حسب مول بیان میکنند. در واقع مبنای محاسبههای کمّی در شیمی، مول است. بیان غلظتی از محلول پرکاربردتر خواهد بود که با مولهای ماده حلشونده و حجم محلول ارتباط داشته باشد. چنین غلظتی را، غلظت مولی (مولار) مینامند.
با هم بیندیشیم صفحه 99
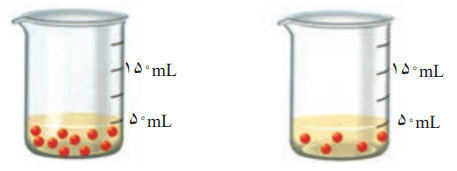
1- شکل زیر دو محلول از یک نوع حلشونده را در آب نشان میدهد. با توجه به آن به پرسشها پاسخ دهید.
آ) کدام کمیت در این محلولها یکسان است؟
حجم محلول
ب) کدام کمیت در این محلولها متفاوت است؟
شمار ذرهها یا مولهای حل شونده
پ) فرض کنید هر ذره حل شونده در شکل همارز با 0.001 باشد. نسبت مولهای حل شونده به حجم محلول (برحسب لیتر) را برای هر یک از دو محلول بهدست آورید.
ت) کمیت بهدست آمده در قسمت «پ»، غلظت مولی نام دارد. آن را در یک سطر تعریف و یکای آن را مشخص کنید.
شمار مولهای حل شونده در یک لیتر یا 1000 میلی لیتر، غلظت مولی (مولاریته) نام دارد. با یکای mol.L-1 بیان میشود.
ث) بر اساس غلظت مولی محاسبه شده، کدام محلول رقیقتر است؟ چرا؟
محلول سمت چپ با غلظت مولی 0.2mol.L-1، غلیظتر از محلول سمت راست با غلظت مولی 0.1mol.L-1 است.
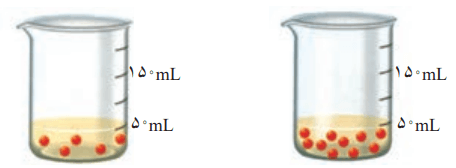
2- با توجه به شکل، هر یک از جملههای زیر را با خطزدن واژههای نادرست کامل کنید.
آ) با افزودن مقداری حل شونده به یک محلول در حجم ثابت، غلظت محلول افزایش مییابد.
ب) با افزودن مقداری حلال به محلولی با غلظت معین، غلظت محلول کاهش مییابد.
نمونه حل شده
برای تهیه 250 میلی لیتر محلول پتاسیم یدید 0.2 مول بر لیتر (مولار) به چند مول حل شونده نیاز است؟
پاسخ:
از دو روش میتوان این سوال را پاسخ داد که در ادامه آنها را بررسی میکنیم.
روش اول
روش دوم
محلول 0.2 مولار پتاسیم یدید نشان میدهد مه در هر لیتر از محلول آن، 0.2 مول KI حل شده است. از آن میتوان به عامل تبدیل و فرمول زیر و در نهایت پاسخ دست پیدا کرد.
آیا نمکها به یک اندازه در آب حل میشوند؟
آمارها نشان میدهند که نزدیک به 3 درصد از جمعیت کشورمان سنگ کلیه دارند. از دلایل این بیماری، میتوان به زمینه ژنشناختی و اختلالات هورمونی اشاره کرد. علاوه بر آن در اثر تغذیه نامناسب، کمتحرکی، مصرف بیش از حد نمک خوراکی، نوشیدن کم آب، مصرف پروتئین حیوانی و لبنیات نیز ایجاد میشود. آیا بین میزان حل شدن نمکها در آب و تشکیل سنگ کلیه رابطهای وجود دارد؟
برای پاسخ به این پزسش، دانستن و درک مفهوم انحلالپذیری ضروری است.
انحلالپذیری
به بیشترین مقدار از یک حل شونده که در 100 گرم حلال و دمای معین حل میشود، انحلالپذیری آن ماده میگویند. در این عبارت، واژه «بیشترین» نشان دهنده رسیدن محلول به حالت سیر شده است. محلولی که نمیتواند حل شونده بیشتری را در خود حل کند.
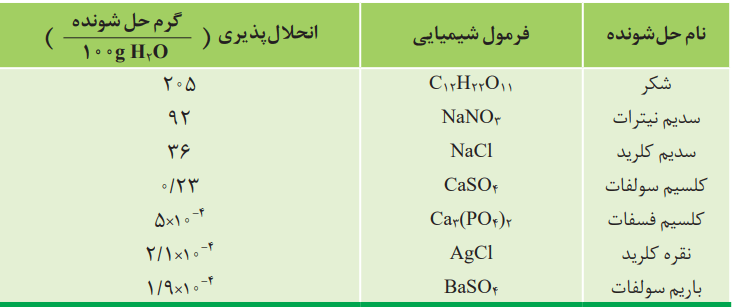
در جدول پایین، انحلالپذیری برخی مواد را در آب و دمای 25 درجه سانتیگراد مشاهده میکنید.
این جدول نشان میدهد که در 25 درجه سانتیگراد در 100 گرم آب، هر مقدار کمتری از 36 گرم سدیمکلرید میتواند در آب حل شود. در عین حال، محلول همچنان در حالت سیر نشده باقی بماند. اگر در همین دما دقیقا 36 گرم سدیم کلرید را در 100 گرم آب حل کنیم، 136 گرم محلول سیر شده بهدست میآید. در این دما برای تهیه محلول سیر شده کلسیم سولفات، باید 0.23 گرم از آن را در 100 گرم آب حل نمود.
خود را بیازمایید صفحه 101
1- اگر 190 گرم سدیم نیترات را در دمای 25 درجه سانتیگراد درون 200 گرم آب بریزیم، پس از تشکیل محلول سیر شده:
آ) چند گرم محلول بهدست میآید؟
ب) چند گرم سدیم نیترات در ته ظرف باقی میماند؟
2- اغلب سنگهای کلیه از رسوب کردن برخی نمکهای کلسیمدار در کلیهها تشکیل میشوند، با این توصیف:
آ) مقدار این نمکها در ادرار افراد سالم از انحلالپذیری آنها کمتر است یا بیشتر؟ چرا؟
چون در کلیه افراد سالم، نمکهای کلسیمدار (نمک سازنده سنگ کلیه) تهنشین نمیشود. مقدار این نمکها در ادرار این افراد از انحلالپذیری آنها در دمای 37 درجه سانتیگراد کمتر بوده و در نتیجه محلول سیر نشده است.
ب) در افرادی که به تشکیل سنگ کلیه مبتلا میشوند، مقدار این نمکها در ادرار از انحلالپذیری آنها کمتر است یا بیشتر؟ چرا؟
بیشتر است. چون در کلیه این افراد، نمکهای کلسیمدار (نمک سازنده سنگ کلیه) تهنشین میشوند. در واقع مقدار این نمکها در ادرار این افراد، بیش از انحلالپذیری آنهاست. اضافی آن بهصورت رسوب یا شن و در نهایت سنگ در میآید. (مصرف مداوم آب میتواند مانع تشکیل سنگ کلیه بشود.)
3- شیمیدانها مواد حل شونده جامد را بر اساس انحلالپذیری در آب و دمای اتاق بهصورت زیر دستهبندی میکنند:
هر یک از ترکیبهای جدول 1 را در این دستهبندی جای دهید.
تاثیر دما بر میزان انحلالپذیری
انحلالپذیری نمکها به نوع آنها و دما بستگی دارد. با این حال تاثیر دما بر میزان انحلالپذیری آنها یکسان نیست. انحلالپذیری برخی نمکها با افزایش دما، افزایش یافته و برخی دیگر کاهش مییابد.
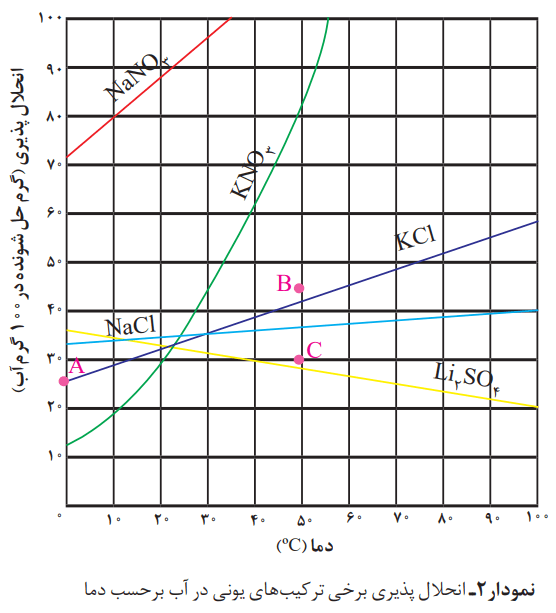
نمودار بالا، نمودار «انحلالپذیری_دما» نامیده میشود که برای هر نمک بر اساس آزمایش و از دادههای تجربی آن بهدست آمده است. مطابق این نمودار با افزایش دما، انحلالپذیری اغلب نمکها افزایش پیدا میکند.
با هم بیندیشیم صفحه 102
با توجه به نمودار 2، به پرسشهای زیر پاسخ دهید.
آ) انحلالپذیری لیتیم سولفات در 85 درجه سانتیگراد چند گرم است؟ در چه دمایی انحلالپذیری آن برابر با 28 گرم است؟
با توجه به نمودار در دمای °85، انحلالپذیری لیتیم سولفات در حدود 23 گرم در 100 گرم آب است. طبق همین نمودار انحلالپذیری 28 گرم مربوط به دمای 50 درجه سانتیگراد است.
ب) هریک از نقطههای B و C نسبت به منحنی انحلالپذیری KCl نشان دهنده چه نوع محلولی است؟ توضیح دهید.
در نقطه C محلول سیر نشده است؛ زیرا گرم جسم حل شونده، کمتر از انحلالپذیری در این دماست. نقطه B هم محلول فراسیر شده را نشان میدهد، زیرا گرم جسم حل شده بیش از میزان انحلالپذیری در این دماست. نقاط روی منحنی انحلالپذیری، محلول سیر شده را در آن دما نشان میدهد.
پ) هنگامی که 133 گرم محلول سیر شده لیتیم سولفات را از دمای 20 درجه تا دمای 70 درجه گرم میکنیم، چه رخ میدهد؟ توضیح دهید.
انحلالپذیری لیتیم سولفات در 20 درجه سانتیگراد برابر با 33 گرم و در 70 درجه برابر با 25 گرم است. انتظار میرود 8 گرم لیتیم سولفات جامد از محلول جدا شده و رسوب کند.
ث) نقطه A روی نمودار انحلالپذیری KCl، عرض از مبدا آن نام دارد. این نقطه نشان دهنده چیست؟ توضیح دهید.
نقطه A (عرض از مبدا) نشان دهنده میزان انحلالپذیری KCl در دمای صفر درجه سلسیوس است.
پیوند با ریاضی صفحه 103
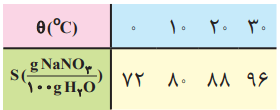
1- دانش آموزی از منابع علمی، انحلالپذیری (S) سدیم نیترات را در دماهای گوناگون (θ) مطابق جدول زیر استخراج کرده است.
او توانست با استفاده از دادههای این جدول، معادله «S=0.8θ+72» را بهدست آورد.
آ) توضیح دهید او چگونه به این معادله دست یافته است؟
S = aθ + b
در رابطه مقابل S انحلالپذیری در دمای مورد نظر و a شیب خط انحلالپذیری است. این شیب از تقسیم تفاوت انحلالپذیری بر تفاوت دما قابل محاسبه است. b عرض از مبدا یا انحلالپذیری در دمای صفر است.
ب) انحلالپذیری سدیم نیترات را در 70 درجه سانتیگراد پیشبینی کنید.
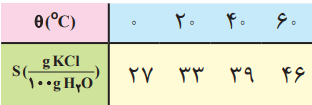
2- با توجه به جدول زیر، معادلهای برای انحلالپذیری پتاسیم کلرید بر حسب دما بهدست آورید.
معادله را از این طریق میتوان بهدست آورد.
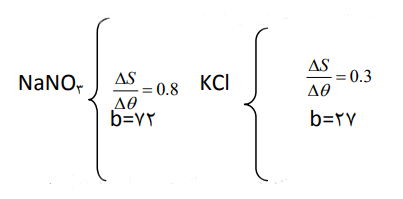
3- با مقایسه دو معادله بهدست آمده برای سدیم نیترات و پتاسیم کلرید:
آ) تاثیر دما بر انحلالپذیری این دو ماده را مقایسه کنید.
با توجه به این دو رابطه، چون شیب خط انحلالپذیری سدیم نیترات (0.8) از شیب خط انحلالپذیری پتاسیم کلرید (0.3) بیشتر است، لذا اثر دما بر انحلالپذیری سدیم نیترات بیشتر است.
ب) توضیح دهید چرا در هر دمایی، انحلالپذیری سدیم نیترات بیشتر از پتاسیم کلرید است؟
در مقایسه انحلالپذیری دو ماده در یک دما با یکدیگر هم شیب و هم عرض از مبدا را باید در نظر گرفت. چون در مورد سدیم نیترات هر دو عامل بزرگتر از پتاسیم کلرید است، در هر دمایی انحلالپذیری آن بیشتر است.
فرم دریافت آموزش های ویدئویی کامل شیمی:
اگه میخوای کل شیمیت رو تو کمترین زمان و با تدریس انیمیشنی مفهومی تستی رتبه 127 کنکور، آقای دکتر متین هوشیار جمع کنی؛ فرم رو پر کن و منتظر تماسمون باش:
روی نمره 20 و درصد بالای 70 شیمی (مثل رتبه های برتر هر سالمون) حساب کن!
برای دسترسی به دیگر درسهای فصل 3 شیمی 10، روی لینک های زیر کلیک کنید: